Quand Prescrire évalue la balance bénéfices-risques d'un médicament et sa praticité, le conditionnement est un élément important à prendre en compte et à analyser. Contribue-t-il à assurer la sécurité des patients et de leur entourage ? Les éléments qui le composent sont-ils sources d'erreurs ou de dangers ? Le conditionnement permet-il une utilisation pratique du médicament, par exemple une mesure précise de la dose à administrer ?
L'analyse du conditionnement prend en compte de nombreux paramètres : la situation clinique ; les patients concernés, par exemple les femmes enceintes, les enfants, les personnes âgées ou celles en situation de handicap (avec par exemple des difficultés de préhension) ; les personnes éventuellement impliquées dans la préparation et l'administration du médicament (entourage, aidant, infirmière) ; le contexte des soins, par exemple dans un établissement de soins, éventuellement avec un caractère d'urgence ; ainsi que dans le cadre d'une prescription, ou encore d'un conseil pharmaceutique ; etc.
Tous les aspects du conditionnement sont analysés sous l'angle de la qualité des soins et de la sécurité des patients et de leur entourage, notamment :
la lisibilité des dénominations communes internationales (DCI) et la différenciation des dosages au sein d'une même gamme de médicaments ;
la clarté des informations présentées sous forme de schémas pour la préparation de la dose à administrer, de plans de prise, ou de pictogrammes ;
les dispositifs de préparation, de mesure ou d'administration des doses ;
le caractère informatif, intelligible et pédagogique des notices, surtout les parties concernant les instructions d'utilisation, les effets indésirables, les situations et groupes de patients à risque ;
le risque pour une personne, par exemple un enfant, d'ingérer le médicament accidentellement.
Ce Palmarès du conditionnement porte sur les conditionnements de médicaments analysés par Prescrire au cours de l'année 2024. Une "Palme du conditionnement" récompense un conditionnement particulièrement bien conçu. Ceux pour lesquels une source d'erreurs ou de dangers a été identifiée font l'objet d'un "Carton rouge du conditionnement".
PALME 2024 DU CONDITIONNEMENT
Un conditionnement bien conçu pour une utilisation plus pratique et plus sûre
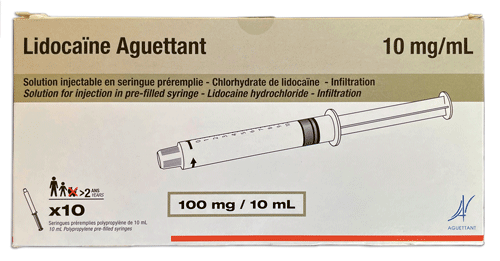
Lidocaïne Aguettant 10 mg/ml solution injectable en seringue préremplie (lidocaïne) - Aguettant (n° 494)
La lidocaïne en seringue préremplie contenant 100 mg dans 10 ml de solution, soit concentrée à 10 mg/ml, est autorisée dans l'anesthésie locale et le bloc nerveux périphérique chez les adultes et les enfants à partir de l'âge de 2 ans, et dans l'anesthésie régionale intraveineuse des membres supérieurs chez les adultes.
Une présentation prête à l'emploi simplifie la préparation aseptique de l'injection. L'embout de type luer-lock de la seringue facilite et sécurise la fixation aux systèmes d'injection. Des graduations tous les 0,5 millilitre sur le corps de la seringue sont utiles pour la mesure de la dose. La quantité de substance par volume total de solution dans la seringue, et la concentration de la solution exprimée en milligrammes par millilitre, sont bien lisibles sur la boîte, ainsi que sur l'emballage et le corps de la seringue. Cette présentation prête à l'emploi est à la fois pratique pour les soignants et sûre pour les patients.
©Prescrire
CARTONS ROUGES DU CONDITIONNEMENT
Des conditionnements exposant à des erreurs d'administration
Vivotif° gélules (Salmonella enterica sérovar Typhi) - Imaxio (n° 492)
Le schéma d'administration de ce vaccin contre la fièvre typhoïde présenté en gélules est inhabituel, avec une gélule à prendre les jours 1, puis 3 et 5. La posologie et les modalités de prise sont détaillées dans la notice. Mais le schéma de prise n'est pas mis en évidence sur la boîte, alors que c'est le premier support d'information des soignants et des patients ; ni au dos de la plaquette, qui est le dernier support d'information avant l'administration. Ces insuffisances font craindre des erreurs, par exemple la prise des 3 gélules en une seule fois, ou la prise d'une gélule par jour pendant 3 jours consécutifs, avec risque de diminution de l'efficacité vaccinale.
Pentacarinat° poudre pour aérosol et pour usage parentéral - Sanofi Winthrop, Pentamidine Tillomed° poudre pour solution injectable ou nébulisation - Tillomed Pharma (pentamidine) (n° 489)
Ces deux spécialités de pentamidine sont toutes deux autorisées dans deux indications différentes, à la fois pour une administration par voie parentérale et par voie inhalée avec un nébuliseur. La possibilité d'utiliser la même spécialité par 2 voies d'administration expose à des erreurs par confusion entre ces voies. De telles erreurs ont été rapportées à l'Agence française du médicament (ANSM) avec la spécialité Pentacarinat°. Un patient a par exemple eu un malaise en lien avec une hypotension artérielle après avoir reçu de la pentamidine par voie intraveineuse alors qu'elle devait être administrée en inhalation.
Vabysmo° solution injectable par voie intravitréenne (faricimab) - Roche (n° 484)
Comme pour d'autres solutions injectables par voie intravitréenne d'anti-VEGF tels que l'aflibercept (Eylea° ou autre) et le ranibizumab (Lucentis° ou autre), seule une partie du volume de la solution contenue dans le flacon du faricimab doit être injectée dans l'œil. Toutefois, la totalité de la solution est à prélever dans le flacon à l'aide de l'aiguille-filtre fournie dans la boîte. Une nouvelle aiguille est alors à fixer sur la seringue, puis le volume excédentaire contenu dans la seringue est à éliminer avant l'injection intravitréenne. Contrairement aux flacons ou aux seringues préremplies d'autres anti-VEGF utilisés par voie intravitréenne, la nécessité d'éliminer le volume excédentaire avant l'injection n'est pas mentionnée sur la boîte de Vabysmo°. Cette absence de mise en garde expose les patients à une surdose et à une augmentation de la pression intraoculaire.
Fintepla° solution buvable (fenfluramine) - UCB Pharma (n° 487)
La fenfluramine (Fintepla°), un amphétaminique, est autorisée en solution buvable dosée à 2,2 mg/ml chez des enfants atteints de certaines épilepsies graves. Elle est à administrer à l'aide d'une seringue pour administration orale graduée en millilitres. La boîte de Fintepla° contient 2 seringues vertes de 3 ml, graduées tous les 0,1 ml, et 2 seringues mauves de 6 ml, graduées tous les 0,2 ml entre 3 et 6 ml. La posologie figurant dans le RCP de Fintepla° est exprimée en mg/kg/jour. Le RCP ne fournit pas de tableau de correspondance avec le volume en millilitres à administrer par prise, mais seulement deux exemples de conversion dans les tableaux posologiques pour les doses maximales recommandées, notamment « 13 mg deux fois par jour soit 6 ml deux fois par jour ». La notice n'est pas plus explicite à ce sujet, en mentionnant « on vous dira combien de ml il faut prendre pour chaque prise ». À cela s'ajoute le risque de confusion lié à la présence de 2 seringues de capacité différente.
Tepkinly° solution injectable (epcoritamab) - AbbVie (n° 494)
L'epcoritamab (Tepkinly°), autorisé dans certains lymphomes diffus à cellules B, est présenté en flacon de solution injectable, avec une solution à diluer dosée à 4 mg/0,8 ml, et une solution prête à l'emploi dosée à 48 mg/0,8 ml. La solution dosée à 4 mg/0,8 ml sert à préparer les 2 premières injections hebdomadaires. Ensuite, c'est la solution dosée à 48 mg/0,8 ml qui est à utiliser. La préparation de la première dose requiert deux dilutions successives, alors qu'une seule dilution est requise pour la deuxième dose ; les dilutions étant à faire à l'aide d'un ou deux flacons vides, non fournis dans la boîte de Tepkinly°. Ce mode de préparation particulier, la nécessité ou non de diluer 1 ou 2 fois la solution, la ressemblance entre les 2 dosages exprimés sur les boîtes et l'absence de mention du volume de solution sur la boîte du dosage à 48 mg sont autant de sources d'erreurs de doses.

©Prescrire

©Prescrire
Une copie avec un dispositif doseur médiocre : un point faible par rapport au princeps
Amisulpride Stragen° solution buvable (amisulpride) - Stragen (n° 486)
La seringue pour administration orale fournie dans la boîte de la solution buvable Solian° (amisulpride) est graduée de 50 mg à 400 mg. La seringue orale de la copie Amisulpride Stragen° est, quant à elle, graduée en millilitres, de 0,5 ml à 5 ml (soit 500 mg), ce qui impose de convertir en millilitres la dose prescrite en milligrammes, avec un risque d'erreurs. De plus, en cas de mesure d'une seringue complète d'Amisulpride Stragen°, soit 500 mg avec la plus haute graduation marquée à 5 ml, le patient est exposé à une surdose s'il est habitué à prendre une seringue complète avec le princeps Solian°, soit 400 mg par prise.
Une évolution insuffisante du conditionnement
Eligard° poudre et solvant pour solution injectable (leuproréline) - Bouchara Recordati (n° 490)
En 2014, à la suite de signalements d'erreurs de préparation et de manipulation avec la spécialité Eligard°, la firme Astellas Pharma s'était engagée auprès de l'Agence européenne du médicament (EMA) à changer le dispositif, qui comprenait alors 2 seringues (l'une de leuproréline et l'autre de solvant) à assembler afin de mélanger leur contenu. En 2024, le conditionnement a évolué, avec 2 seringues déjà reliées entre elles, réduisant de 15 à 8 le nombre d'étapes de préparation de la dose. Malgré cette évolution, des risques d'erreurs persistent en raison des 60 cycles de mélange nécessaires pour préparer la solution injectable, avec de possibles conséquences sur la viscosité de la solution obtenue, notamment des difficultés d'administration en cas de viscosité excessive. Subsistent aussi des problèmes concernant la fixation de l'aiguille, parfois trop ou insuffisamment serrée, conduisant à des fissures dans le premier cas et à des pertes de produit dans les deux cas.
Un conditionnement inutilisable dans une indication pédiatrique
Fragmine° 2 500 UI anti Xa/0,2 ml solution injectable en seringue préremplie (daltéparine) - Pfizer (n° 487)
La daltéparine est la première héparine de bas poids moléculaire (HBPM) autorisée en France dans le traitement de la thrombose veineuse chez les enfants à partir de l'âge de 1 mois. Le RCP français de Fragmine° propose dans cette situation clinique d'utiliser des flacons multidoses de daltéparine dosée à 10 000 UI/ml ou à 25 000 UI/ml qui ne sont pas commercialisés en France. Le RCP précise aussi qu'ils contiennent de l'alcool benzylique, qui est à éviter chez les enfants de moins de 3 ans. La seringue préremplie de daltéparine à 2 500 UI/0,2 ml, c'est-à-dire le dosage le plus faible commercialisé en France, est dépourvue de graduations pour mesurer la dose requise chez ces jeunes enfants. Début 2025, tout cela complique fortement l'administration sans erreur d'une dose de daltéparine à un très jeune enfant en France.