Résumé
En 2016, peu de progrès se distinguent dans un flot de médicaments sans intérêt clinique, d'efficacité incertaine ou à balance bénéfices-risques défavorable. Le système d'incitation à la recherche et au développement est en cause. Il n'est pas orienté vers les besoins des patients et n'assure pas la mise à disposition à prix abordables de médicaments qui constituent de véritables progrès thérapeutiques.
Tous les mois, Prescrire analyse de manière systématique, méthodique et indépendante, les nouvelles substances, les nouvelles indications autorisées pour des médicaments déjà commercialisés, ainsi que les nouveaux dosages, les nouvelles formes pharmaceutiques, etc. L'objectif de ce travail est de repérer parmi toutes les nouveautés médicamenteuses les vrais progrès pour les patients.
En 2016, 92 dossiers d'évaluation clinique de médicaments ont été analysés par la Rédaction de Prescrire. Nous vous présentons ici un bilan de ces 92 analyses.
Lire : Cotations des nouvelles spécialités et des nouvelles indications dans Prescrire depuis 10 ans
2016 : encore peu de vrais progrès
En 2016, selon l'analyse de Prescrire, seules 15 nouveautés médicamenteuses (nouveaux médicaments ou nouvelles indications de médicaments) ont apporté un progrès.
Quelques progrès notables, particulièrement en cancérologie
Ainsi, en 2016, 6 nouveautés médicamenteuses ont apporté un progrès thérapeutique notable : elles ont été cotées "Intéressant" (1 nouveauté médicamenteuse) ou "Apporte quelque chose" (5 nouveautés médicamenteuses) (lire le tableau ci-dessous). Quatre de ces nouveautés ont concerné des patients atteints d'un cancer : le nivolumab (Opdivo°), un immunostimulant, dans le mélanome métastasé ou inopérable sans mutation BRAF V600 (n° 393 p. 500-1à5) et dans le cancer bronchique non à petites cellules après échec d'une chimiothérapie contenant un sel de platine (n° 397 p. 807-808) ; le tramétinib (Mekinist°), un inhibiteur de kinases du système MEK, en association avec le dabrafénib (Tafinlar°), un inhibiteur de la protéine BRAF, dans le mélanome métastasé ou inopérable avec mutation BRAF V600 (n° 393 p. 490-1à6) ; un dosage fort de dexaméthasone à 40 mg (Neofordex°), un corticoïde, dans le myélome multiple (n° 395 p. 660).
Les deux autres nouveautés ayant apporté un progrès concernent les enfants : l'entécavir (Baraclude°), un antiviral, chez des enfants atteints d'hépatite B chronique (n° 392 p. 411-412) ; le succimer (Succicaptal°), un chélateur de métaux lourds, à un dosage faible (100 mg), en cas d'intoxication par le plomb ou le mercure (n° 392 p. 421).
Neuf nouveautés médicamenteuses ont apporté un progrès modeste (cotées "Éventuellement utile"). C'est le cas par exemple de la témocilline (Negaban°), utile dans certaines infections à bactéries Gram négatif en raison de son spectre antibactérien étroit (n° 393 p. 499-500) ; des formes buvables de riluzole (Teglutik°) dans la sclérose latérale amyotrophique, et de l'acide alendronique hebdomadaire (Steovess°) dans l'ostéoporose, parfois utiles chez les patients ayant des difficultés à avaler des comprimés (n° 396 p. 736 et 740).
Un flot de nouveautés médicamenteuses sans progrès ou dangereuses
En 2016, plus de la moitié des nouveautés médicamenteuses n'ont pas apporté de progrès pour les soins par rapport à l'existant, que ce soit en termes d'efficacité, d'effets indésirables ou de praticité. Ainsi, 56 nouveautés médicamenteuses ont été cotées "N'apporte rien de nouveau". Pour 5 autres, la balance bénéfices-risques est très incertaine au vu des données disponibles en appui de l'autorisation de mise sur le marché (AMM) ou de l'avis de l'Agence européenne du médicament (cotation "Ne peut se prononcer"), dont 3 médicaments en cancérologie.
Plus grave, 16 nouveautés médicamenteuses ont été cotées "Pas d'accord", le plus souvent en raison d'effets indésirables disproportionnés en regard d'un intérêt clinique faible, voire inexistant ou non démontré (lire le tableau ci-dessous). Même en cas d'impasse thérapeutique dans des situations désespérées, certains nouveaux médicaments ne devraient être utilisés que dans le cadre d'une recherche clinique contrôlée. D'autres nouveautés sont purement à écarter, par exemple l'adalimumab dans l'hidrosadénite suppurée ou le fébuxostat dans le syndrome de lyse tumorale (lire aussi "Pour mieux soigner, des médicaments à écarter : bilan 2017").
Me too et "innovations ciblées" : poudre aux yeux
La nature des nouveautés médicamenteuses analysées en 2016 est très proche de celle des nouveautés analysées les années précédentes.
"Me-too" : un objectif de conquête de marché mais pas de progrès
Beaucoup de nouveautés médicamenteuses sont en fait des "me-too" ("moi aussi" en français, sous-entendu "moi aussi je veux ma part du marché"), c'est-à-dire des médicaments très similaires à des médicaments déjà existants.
À cet égard, le marché pléthorique des bronchodilatateurs dans la bronchopneumopathie chronique obstructive est très illustratif, avec, en 2016, un nième bêta-2 stimulant de longue durée d'action, l'olodatérol (Striverdi Respimat°), et un nième atropinique de longue durée d'action, l'uméclidinium (Incruse Ellipta°, et dans Anoro Ellipta° avec le vilantérol) (n° 387 p. 9, n° 393 p. 488-489).
Dans le domaine des antibiotiques, la dalbavancine (Xydalba°) est un glycopeptide "me-too" de la téicoplanine (Targocid°), et le tédizolid (Sivextro°), une oxazolidinone, un "me-too" du linézolide (Zyvoxid° ou autre) (n° 387 p. 12, n° 397 p. 813-815).
Ou encore : le sonidégib (Odomzo°) est un antitumoral "me-too" du vismodégib (Erivedge°) (n° 395 p. 652-654).
Ces "me-too" n'apportent pas de progrès en termes de soins : ils sont surtout le reflet d'un marché de la santé très attractif pour les firmes dans certains domaines.
Antitumoraux : thérapies dites ciblées, mais aux cibles nombreuses
23 nouveautés médicamenteuses analysées en 2016 concernent le domaine de la cancérologie, où les attentes des patients sont importantes. Mais les données d'évaluation montrent que beaucoup de ces médicaments n'apportent pas de progrès notable en termes d'amélioration sur la durée de vie ou sur la proportion de patients guéris par rapport à d'autres traitements disponibles.
L'AMM de certaines nouveautés médicamenteuses autorisées dans des cancers a été octroyée sur la base de données trop insuffisantes pour que l'on puisse déterminer leur balance bénéfices-risques. C'est le cas de l'ibrutinib (Imbruvica°) dans le lymphome du manteau et la leucémie lymphoïde chronique (n° 387 p. 10), du dénosumab (Xgeva°) dans les tumeurs osseuses à cellules géantes (n° 388 p. 95-96) et du lenvatinib (Lenvima°) dans les cancers différenciés de la thyroïde (n° 398 p. 893-895).
Beaucoup d'antitumoraux font partie de thérapies dites ciblées, c'est-à-dire visant des particularités moléculaires à l'origine de la prolifération des cellules cancéreuses, de la formation de nouveaux vaisseaux sanguins, etc. Les actions de ces médicaments sont en réalité complexes et multiples, et non spécifiques aux cellules cancéreuses, d'où de nombreux effets indésirables (n° 382 p. 610-612).
Par exemple, le nintédanib (Ofev°, Vargatef°), un inhibiteur de multiples tyrosine kinases, est autorisé dans la fibrose pulmonaire du fait de son activité inhibitrice de la tyrosine kinase liée au FGF (fibroblast growth factor), et dans le cancer bronchique non à petites cellules du fait de son activité inhibitrice de l'angiogenèse par inhibition de la tyrosine kinase liée aux récepteurs du facteur de croissance de l'endothélium vasculaire (VEGF en anglais). Pour autant, quelle que soit la situation, le nintédanib expose à de nombreux effets indésirables graves liés notamment à son effet antiangiogenèse, dont : thromboses veineuses, hémorragies, hypertensions artérielles, perforations digestives, troubles de la cicatrisation (n° 389 p. 178-1à4).
D'autres antitumoraux présentés aussi comme très spécifiques de certaines enzymes, par exemple des inhibiteurs de kinases JAK1 et JAK2 (ruxolitinib), ALK (céritinib), MEK (cobimétinib, tramétinib) ou de Bruton (ibrutinib), exposent à des effets indésirables qui touchent de très nombreux organes (n° 390 p. 246-250 et 252, n° 391 p. 337-338, n° 393 p. 490, n° 395 p. 655-656).
Anticorps monoclonaux : dans des situations très diverses
Les anticorps monoclonaux sont aussi présentés comme des thérapies ciblées. D'abord surtout utilisés en cancérologie, les firmes les ont développés dans des situations très diverses. En 2016, 17 nouveautés médicamenteuses ont concerné des anticorps monoclonaux, par exemple, des AMM ont été octroyées : à l'évolocumab (Repatha°) et à l'alirocumab (Praluent°) dans l'hypercholestérolémie (n° 391 p. 331) ; à l'idarucizumab (Praxbind°) comme antidote du dabigatran (Pradaxa°) (n° 393 p. 494-499) ; au mépolizumab (Nucala°) dans l'asthme (n° 395 p. 657-659) ; au sécukinumab (Cosentyx°) dans le psoriasis, le rhumatisme psoriasique et la spondylarthrite ankylosante (n° 396 p. 727-732, n° 398 p. 895).
Ces anticorps sont souvent présentés comme de grandes innovations. Mais ici aussi, l'étude pragmatique des dossiers d'évaluation clinique montre que, le plus souvent, ces médicaments vendus très chers sont sans progrès démontré pour les patients.
Déficit d'évaluation avant l'octroi d'une AMM
L'analyse des données sur la base desquelles sont octroyées les AMM montre que souvent ces données sont insuffisantes pour déterminer convenablement la balance bénéfices-risques de la nouveauté médicamenteuse par rapport à ce qui est déjà disponible. Pourtant, l'Agence européenne du médicament (EMA) continue à vouloir réduire les exigences avant AMM.
AMM "fractionnées" : une évolution dangereuse pour les patients
En 2014, l'EMA a ainsi mis en place un projet-pilote de procédure d'AMM dites fractionnées ("adaptive pathways" en anglais). Ce nouveau mode d'évaluation vise à accélérer la mise sur le marché de nouveaux médicaments sur la base de données d'évaluation réduites, au motif de favoriser un accès précoce des patients à certains médicaments. Ce projet est très critiqué, car le risque est élevé d'exposer inutilement des patients à des effets indésirables graves, sans preuve d'efficacité. En 2016, l'EMA a publié un rapport sur ce projet-pilote qui ne montre aucun avantage des AMM "fractionnées" pour les patients (n° 390 p. 293-299, n° 398 p. 932).
Ce projet d'AMM "fractionnées", en plus d'être dangereux, est inutile puisque dans l'Union européenne, il existe déjà des possibilités réglementaires pour l'accès prématuré à des médicaments destinés à des situations d'impasse thérapeutique qui menacent le pronostic vital à court terme. Il s'agit des AMM "pour circonstances exceptionnelles", des AMM "conditionnelles" et des procédures d'"usage compassionnel".
Évaluation clinique déficiente
Même sans AMM "fractionnées", l'EMA rend déjà de longue date des avis favorables à des demandes d'AMM sur la base de données insuffisantes, assorties de demandes d'études post-AMM qui sont souvent longues à aboutir, quand elles aboutissent.
Parmi les nouveaux médicaments analysés en 2016, l'olaparib (Lynparza°) dans le cancer de l'ovaire a été autorisé sur la base d'un essai clinique de phase II, c'est-à-dire après une phase seulement exploratoire de l'efficacité de ce médicament, chez un nombre restreint de patientes. Le délai avant aggravation radiologique du cancer a été allongé en moyenne de quelques mois, mais il n'est pas démontré que ce critère intermédiaire soit lié à une amélioration des symptômes ou à un allongement de la durée de vie (n° 392 p. 406-410, n° 396 p. 783).
Les AMM du céritinib (Zykadia°) dans le cancer du poumon non à petites cellules (n° 390 p. 252), et de l'ibrutinib (Imbruvica°) dans la macroglobulinémie de Waldenström (n° 391 p. 337-338), ont été octroyées sur la base d'essais non comparatifs, sans évaluation adéquate de l'efficacité, alors que l'EMA avait connaissance d'essais comparatifs en cours au moment de l'évaluation du dossier d'AMM.
Dans le psoriasis et en rhumatologie, l'absence d'essai versus traitement de référence a été courante, comme pour le golimumab (Simponi°) (n° 393 p. 489) ou l'ustékinumab (Stelara°) (n° 396 p. 733-734).
L'évaluation du sécukinumab (Cosentyx°) fait figure d'exception : il a été évalué dans le psoriasis versus étanercept (Enbrel° ou autre), versus ustékinumab et versus placebo (n° 396 p. 727-732). Cette évaluation comparative pertinente a été utile pour déterminer quelques situations cliniques précises dans lesquelles sa balance bénéfices-risques semble favorable.
Prix élevés : dérives avec des antitumoraux
Sous couvert de l'"innovation" thérapeutique, certaines firmes commercialisent des médicaments à des prix très élevés qui ne sont pas fixés en fonction du coût de la recherche et du développement, ni du progrès réel apporté aux patients (n° 398 p. 933-939). Aux États-Unis d'Amérique, entre 1995 et 2013, le prix de 58 antitumoraux a augmenté d'environ 12 % par an, alors que les médicaments les plus récents n'ont pas augmenté de manière notable la durée de vie par rapport aux médicaments plus anciens (n° 389 p. 217).
Parmi les nouveaux médicaments présentés en 2016 dans Prescrire, la dépense pour les médicaments utilisés en cancérologie s'élève à environ 6 000 euros par mois par patient en France, indépendamment de leur balance bénéfices-risques ou du progrès apporté. Sont notamment concernés : l'ibrutinib (Imbruvica°) coté "Ne peut se prononcer" dans le lymphome du manteau et la leucémie lymphoïde chronique, et "N'apporte rien de nouveau" dans la macroglobulinémie de Waldenström (6 000 euros à 8 100 euros par mois) ; le céritinib (Zykadia°) coté "Pas d'accord" dans le cancer du poumon non à petites cellules (6 690 euros par mois) ; le nivolumab (Opdivo°) coté "Intéressant" dans les mélanomes métastasés ou inopérables sans mutation BRAF V600, et "Apporte quelque chose" dans le cancer bronchique métastasé ou inopérable (environ 6 000 euros par mois dans le cadre de l'autorisation temporaire d'utilisation (ATU) en France) ; le cobimétinib (Cotellic°) coté "N'apporte rien de nouveau" dans les mélanomes métastasés (6 300 euros par mois) ; le ramucirumab (Cyramza°) coté "N'apporte rien de nouveau" dans le cancer colorectal métastasé (environ 6 000 euros par mois) ; le pembrolizumab (Keytruda°) coté "N'apporte rien de nouveau" dans les mélanomes métastasés ou inopérables (6 400 euros par mois) ; le crizotinib (Xalkori°) coté "N'apporte rien de nouveau" en première ligne dans certains cancers bronchiques (5 500 euros par mois) ; le lenvatinib (Lenvima°) coté "Ne peut se prononcer" dans les cancers différenciés de la thyroïde (environ 6 000 euros par mois) (n° 387 p. 10-1à6, n° 390 p. 252, n° 391 p. 337-338, n° 393 p. 500-1à5, n° 395 p. 655-656, n° 397 p. 807-808 et 815-817, n° 398 p. 889-895).
Adopter un système qui permette de répondre aux besoins des patients
Année après année, les défauts du marché du médicament se perpétuent : prix élevés sans lien avec les coûts réels de développement et de production, spéculation financière et course aux profits à court terme, insuffisance des exigences par les agences du médicament. C'est tout un système qui ne favorise pas une recherche pharmaceutique visant de vrais progrès thérapeutiques (n° 398 p. 933-939).
L'évaluation des médicaments est de plus en plus reportée après l'AMM, plaçant les patients en situation de cobayes, la solidarité nationale en financeur involontaire de l'évaluation des médicaments, et les firmes en situation de conflit d'intérêts puisque les résultats de telles études post-AMM sont susceptibles de nuire à l'image de leurs médicaments.
En 2016, très peu de patients ont bénéficié d'avancées tangibles en matière de nouveautés médicamenteuses. Les firmes pharmaceutiques semblent surtout faire des opérations financières, n'hésitant pas à cesser de produire des substances éprouvées et utiles dans certaines situations mais peu rentables tels la spectinomycine (ex-Trobicine°) (n° 397 p. 820) et le probénécide (ex-Benemide°) (n° 398 p. 903).
L'amélioration des soins et la protection des patients ne semblent pas au centre des priorités des agences du médicament. "Me-too", autorisations de mise sur le marché sans preuve de progrès thérapeutique : le système d'incitation à la recherche et au développement pharmaceutique conduit tout un secteur à investir plus dans l'imitation et la capture de parts de marché, que dans une recherche de progrès thérapeutiques probants.
À quand un nouveau système de l'économie du médicament qui entraîne les firmes et les États à orienter la recherche et le développement vers les principaux besoins en santé, à un coût abordable ?
Synthèse élaborée collectivement par la Rédaction
sans aucun conflit d'intérêts
©Prescrire
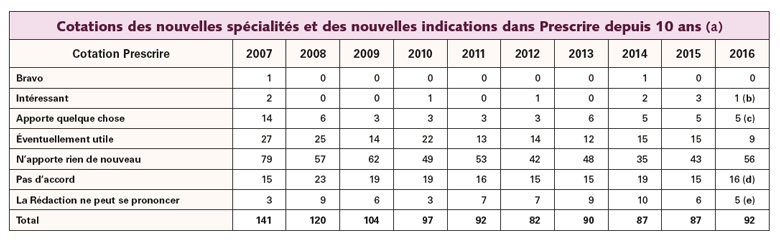
a- Les lecteurs intéressés par les résultats des années 1981 à 2006 peuvent les retrouver dans le n° 213 p. 59 et le n° 280 p. 142. Ce tableau comprend les nouvelles spécialités (hormis les copies) et les nouvelles indications ainsi que les réanalyses "avec plus de recul".
b- Il s'agit du nivolumab (Opdivo°) dans les mélanomes métastasés ou inopérables sans mutation BRAF V600 (n° 393 p. 500-1à5).
c- Il s'agit :
– de la dexaméthasone (Neofordex°) à 40 mg dans le myélome multiple (n° 395 p. 660) ;
– de l'entécavir (Baraclude°) dans l'hépatite B chronique chez les enfants (n° 392 p. 411-412) ;
– du nivolumab (Opdivo°) dans certains cancers bronchiques métastasés ou inopérables (n° 397 p. 807-808) ;
– du succimer (Succicaptal°) à 100 mg dans les intoxications par le plomb (alias saturnisme) ou par le mercure (n° 392 p. 421) ;
– du tramétinib (Mekinist°) dans les mélanomes métastasés ou inopérables avec mutation BRAF V600 (n° 393 p. 490-1à6).
d- Il s'agit :
– de l'adalimumab (Humira°) dans l'hidrosadénite suppurée (alias maladie de Verneuil) (n° 397 p. 809-810) ;
– de la capsaïcine (Qutenza°) dans les douleurs neuropathiques diabétiques (n° 396 p. 734-736) ;
– du céritinib (Zykadia°) dans certains cancers du poumon non à petites cellules (n° 390 p. 252) ;
– de la ciclosporine en collyre (Ikervis°) dans la sécheresse oculaire (n° 397 p. 805-806) ;
– de l'association estradiol + dydrogestérone (Climaston°) à 0,5 mg/2,5 mg dans le traitement hormonal substitutif de la ménopause (n° 388 p. 103) ;
– du fébuxostat (Adenuric°) dans l'hyperuricémie liée à un syndrome de lyse tumorale (n° 389 p. 177-178) ;
– de l'idébénone (Raxone°) dans la neuropathie optique de Leber (n° 395 p. 651-652) ;
– de l'association insuline dégludec + liraglutide (Xultophy°) dans le diabète de type 2 (n° 398 p. 896) ;
– du mépolizumab (Nucala°) dans l'asthme persistant sévère (n° 395 p. 657-659) ;
– du nintédanib (Vargatef°) dans certains cancers bronchiques non à petites cellules inopérables (n° 389 p. 178-1à4) ;
– du nintédanib (Ofev°) dans la fibrose pulmonaire idiopathique (n° 389 p. 180-1à4) ;
– de l'olaparib (Lynparza°) dans certains cancers de l'ovaire (n° 392 p. 406-410) ;
– du panobinostat (Farydak°) dans le myélome multiple (n° 392 p. 413-1à5) ;
– du prucalopride (Resolor°) dans la constipation chronique chez les hommes (n° 391 p. 336-337) ;
– de l'association simvastatine + fénofibrate (Cholib°) dans l'hypercholestérolémie et l'hypertriglycéridémie (n° 390 p. 255) ;
– de la tigécycline (Tygacil°) dans les infections graves chez les enfants (n° 390 p. 258).
e- Il s'agit :
– du dénosumab (Xgeva°) dans les tumeurs osseuses à cellules géantes (n° 388 p. 95-96) ;
– de l'empagliflozine seule (Jardiance°) ou associée avec la metformine (Synjardy°) dans le diabète de type 2 (n° 389 p. 168-173) ;
– de l'ibrutinib (Imbruvica°) dans la leucémie lymphoïde chronique et le lymphome à cellules du manteau (n° 387 p. 10-1à6) ;
– du lenvatinib (Lenvima°) dans les cancers différenciés de la thyroïde (n° 398 p. 893-895) ;
– du vaccin paludique RTS,S/AS01E (Mosquirix°) dans l'immunisation contre le paludisme et l'hépatite B chez les enfants (n° 396 p. 725-726).