Résumé
En 2022, Prescrire a analysé 190 conditionnements de médicaments. Une fois encore, quelques progrès sont à saluer, mais de nombreux défauts sont encore à déplorer.
L'identification correcte de certaines spécialités a été sécurisée par une mise en avant de la dénomination commune internationale (DCI) ainsi que par de bonnes différenciation et visibilité des dosages.
Quelques progrès pratiques ont été constatés, comme des formes prêtes à l'emploi pour des médicaments injectables, ou des formes orales présentées en plaquettes unitaires prédécoupées. Mais de trop nombreuses spécialités pharmaceutiques sont encore commercialisées en flacons-vrac.
L'évolution de conditionnements déjà connus comme sources potentielles d'erreurs a donné lieu à des corrections, mais trop partielles.
L'arrivée de copies génériques est une opportunité pour mettre sur le marché des conditionnements plus pratiques et plus sûrs. Mais, en 2022, cette occasion a été trop peu saisie.
Le conditionnement d'un médicament est un objet physique manipulé par les patients, leur entourage, les aidants et les soignants. Il importe qu'il soit bien conçu pour être facile à utiliser et ne pas être source de dangers liés à une éventuelle erreur. En 2022, Prescrire a analysé le conditionnement de 190 spécialités pharmaceutiques ayant fait l'objet d'un texte publié dans la rubrique "Rayon des nouveautés". Parmi ces conditionnements, quelles sont les caractéristiques à saluer ? Des défauts ont-ils été observés ? Les modifications des conditionnements repérées par Prescrire en 2022 ont-elles amené un progrès pratique et amélioré la sécurité d'emploi ?
Dénomination commune internationale et dosage : des éléments majeurs pour l'identification des médicaments
La dénomination commune internationale (DCI) est le vrai nom du médicament car c'est celui de la substance dite active. La DCI comprend le plus souvent un segment-clé qui permet de déduire dans une certaine mesure l'action pharmacologique et le profil d'effets indésirables du médicament. Sur l'étiquette du conditionnement dit primaire, c'est-à-dire celui au contact direct avec le médicament lui-même (flacon, ampoule, plaquette, etc.), et sur la boîte, la mention du dosage à la suite de la DCI, et parfois de la forme pharmaceutique, complète l'identification correcte d'une spécialité pharmaceutique et contribue à limiter certaines erreurs lors de la dispensation et de l'administration.
Prévention des erreurs de lecture de certaines DCI
Penser, communiquer et prescrire en DCI contribue à une bonne pratique professionnelle et à la sécurité des patients. Quand le nom commercial est un nom de fantaisie qui ne comporte pas la DCI, les patients sont exposés à la prise de la même substance dans des spécialités pharmaceutiques aux noms commerciaux différents. Ceci expose à des confusions entre spécialités, regroupées par exemple sous un nom de marque commun dans une gamme ombrelle.
Malgré tout, des confusions entre DCI elles-mêmes surviennent aussi, avec des conséquences parfois graves. Pour améliorer leur différenciation, l'emploi sur les conditionnements de caractères d'accroche, c'est-à-dire la mise en majuscules de certaines lettres des DCI est l'une des mesures recommandées par plusieurs agences du médicament (1à4). C'est le cas par exemple pour la dobutamine susceptible d'être confondue avec la dopamine. Au sein du nom commercial mentionné sur les éléments du conditionnement de la spécialité Dobutamine Sun° 5 mg/ml en solution pour perfusion en seringue préremplie, la DCI comporte ainsi des caractères d'accroche : DOBUTamine.
Le trastuzumab est un anticorps monoclonal antitumoral indiqué dans certains cancers du sein. Il est commercialisé seul ou conjugué à un agent cytotoxique, formant ainsi la trastuzumab emtansine ou le trastuzumab déruxtécan. À toutes les étapes du soin, une attention particulière doit être portée afin de ne pas confondre les spécialités contenant ces formes différentes de trastuzumab. De telles confusions ont entraîné des erreurs de doses mortelles pendant les essais cliniques (5). Sur la boîte et sur l'étiquette du flacon du trastuzumab déruxtécan (Enhertu°), la DCI est bien visible grâce à l'emploi de caractères gras et d'un surlignage orange contribuant à l'identification correcte de ce médicament.


©Prescrire
Enhertu° (trastuzumab déruxtécan)
Minimisation voire absence de la DCI : encore en 2022
Parmi les spécialités pharmaceutiques analysées en 2022, nous avons constaté encore trop de DCI minimisées, voire absentes d'éléments du conditionnement primaire. Par exemple, sur la plaquette de Xonvéa° (doxylamine + pyridoxine), les DCI sont mentionnées une seule fois au dos, en très petits caractères. Et les DCI sont tout simplement absentes sur les dosettes des collyres Xiop° (latanoprost) et Zagrapa° (kétotifène).
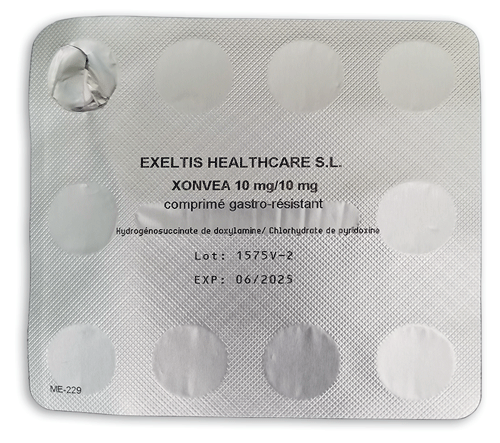
©Prescrire
Xonvéa° (doxylamine + pyridoxine)
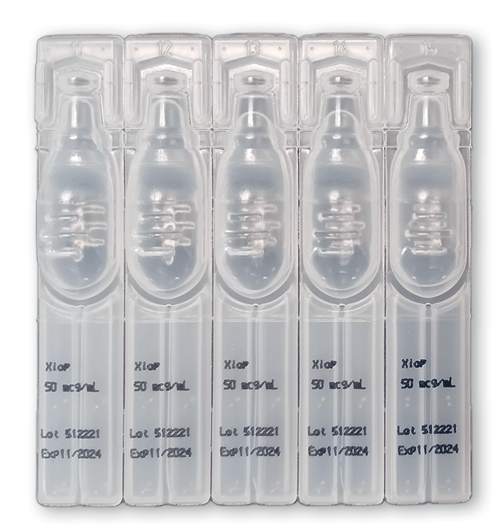
©Prescrire
Xiop° (latanoprost)
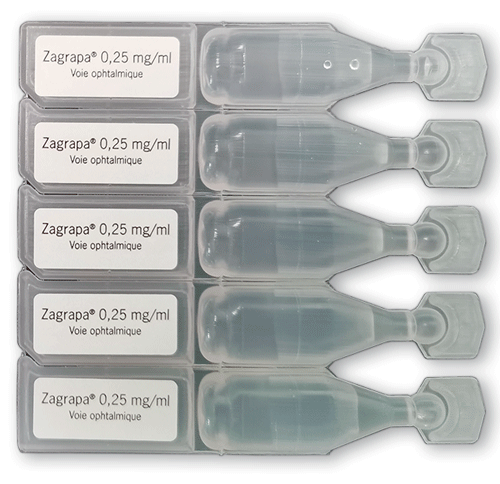
©Prescrire
Zagrapa° (kétotifène)
Des médicaments plus sûrs et plus pratiques à utiliser en 2022 ?
Un conditionnement de qualité vise à assurer la sécurité d'emploi des médicaments et une utilisation pratique. Parmi les conditionnements de médicaments analysés en 2022, quelques progrès sont à noter, mais aussi des régressions.
Des médicaments injectables prêts à l'emploi
Les formes prêtes à l'emploi évitent une étape de préparation et sont à préférer car elles constituent une barrière de sécurité contre des erreurs de dose. La spécialité Irinotécan Sun° est la première présentation d'irinotécan injectable déjà diluée en poche prête à l'emploi. Les autres spécialités d'irinotécan sont commercialisées en flacons de solution à diluer, ce qui contraint à mobiliser une équipe spécialisée pour préparer la dose, avec une étape de dilution à risque d'erreurs.
La Dobutamine Sun° est un autre exemple de solution injectable prête à l'emploi bienvenue, ici destinée à être utilisée dans un pousse-seringue. Il s'agit de la première présentation de dobutamine prête à l'emploi, permettant aux soignants de gagner un temps précieux dans un contexte d'urgence.
En décembre 2022, l'Agence française du médicament (ANSM) a publié sur son site des recommandations pour limiter les erreurs de doses parfois mortelles avec les solutions concentrées de chlorure de potassium. Ces solutions concentrées nécessitent d'être diluées avant injection. Malheureusement, depuis mi-2020, il ne reste plus de solution prédiluée de chlorure de potassium commercialisée en France, alors que leur emploi est utile pour limiter les erreurs et les dangers mortels liés aux solutions concentrées (7,8).
Absence de dosages adaptés imposant d'injecter la dose préconisée en plusieurs fois
Certains médicaments examinés par Prescrire en 2022 sont commercialisés avec des dosages qui obligent à réaliser de 2 à 4 injections au même moment de la journée pour administrer la dose préconisée (9). C'est le cas de la solution injectable Adtralza° (tralokinumab) 150 mg en seringues préremplies. La boîte de 4 seringues d'Adtralza° contient 2 boîtes de 2 seringues préremplies. Sur le rabat de la boîte de 2 seringues figure un pictogramme « répéter » et la mention « Ensuite, utilisez les deux seringues. Pour une dose de 300 mg, deux seringues de 150 mg sont nécessaires. Injectez la première seringue, et ensuite la seconde ». Pour la dose initiale de 600 mg de tralokinumab, il est nécessaire d'injecter le contenu des 4 seringues.
Sur la boîte de 2 seringues préremplies de Tysabri° (natalizumab), les mentions « Utiliser 2 seringues de 150 mg » et « Dose complète = 300 mg » sont accompagnées du visuel de 2 seringues reliées par le signe « + ». Des mentions similaires sont présentes sur la boîte des seringues ou des stylos préremplis de Bimzelx° (bimékizumab).
Ces mentions de précautions quant à la nécessité d'injecter la dose en plusieurs fois limitent peut-être des erreurs, mais la commercialisation de dosages mieux adaptés aux posologies préconisées, y compris dans de nouvelles indications pour une spécialité déjà existante, serait une option plus pratique pour les patients.
Des opportunités à mieux saisir pour faire évoluer les conditionnements
Les conditionnements des médicaments évoluent peu, ou trop lentement. Il arrive que des erreurs survenues au cours d'essais cliniques motivent des modifications du conditionnement avant la commercialisation d'un médicament (10). Plus fréquemment, ce sont des alertes liées à des erreurs ou des défauts repérés après la commercialisation qui amènent les agences du médicament à demander aux firmes pharmaceutiques des changements sur les conditionnements. L'arrivée de copies génériques est aussi une opportunité pour améliorer la qualité et la sécurité des soins en proposant un conditionnement de meilleure qualité que celui de certains princeps. Mais cette occasion n'est que trop peu saisie.
Conditionnement d'une copie générique : dommage de ne pas faire mieux que le princeps
La DCI tacrolimus n'est pas mise en avant sur la boîte et les plaquettes de la spécialité Conferoport° (tacrolimus) en gélules à libération prolongée, copie d'Advagraf°. La prise de tacrolimus à libération prolongée nécessite souvent la prise de plusieurs gélules en une seule fois par jour, ce qui est mentionné sur la boîte d'Advagraf°, mais pas sur les boîtes de Conféroport°. L'absence de cette mention expose à des erreurs de prise.
Le choix d'un nom commercial de fantaisie a aussi été fait pour le gel Closalis° (dexaméthasone + calcipotriol), copie de Daivobet°. Les DCI sont très peu visibles sur la boîte et le tube de gel. Sur la boîte, aucun pictogramme "grossesse" ne met en garde contre l'utilisation de ce médicament chez les femmes enceintes, alors qu'un pictogramme de danger est présent sur la boîte de Daivobet°. Il n'est pas cohérent que deux spécialités appartenant au même groupe générique n'accordent pas le même niveau d'information aux patientes enceintes ou pouvant le devenir.
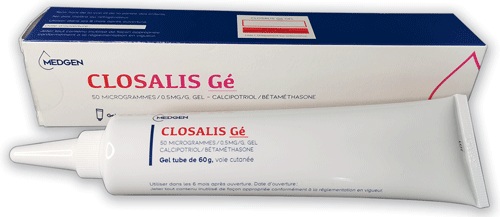
©Prescrire
Closalis Gé° (dexaméthasone + calcipotriol)

©Prescrire
Daivobet° (dexaméthasone + calcipotriol)
D'autres copies comportent encore des noms de fantaisie au lieu de la DCI, tels Divalcote° (valproate semisodique), Leptax° (lévétiracétam), Izixate° (méthotrexate), ces deux derniers prêtant à confusion, respectivement avec les noms commerciaux Lepticur° (tropatépine) et Inhixa° (énoxaparine).
En somme : des progrès trop limités pour être à la hauteur des enjeux
Parmi les conditionnements analysés par la Rédaction de Prescrire en 2022, quelques évolutions positives qui améliorent la praticité ou la sécurité, notamment par une meilleure identification des spécialités, sont à saluer. Quelques régressions et surtout beaucoup d'opportunités ratées pour améliorer les différents aspects d'un conditionnement sont toutefois à regretter. Une approche globale est nécessaire pour obtenir un conditionnement abouti, pratique et sûr. Le conditionnement des médicaments ne semble pas être un sujet de préoccupation majeure pour les firmes pharmaceutiques, qui se limitent souvent à des changements minimaux quand un conditionnement doit être modifié. Pourtant c'est aux firmes de réaliser des conditionnements de qualité pour les nouvelles spécialités, y compris les copies, et aussi pour sécuriser les conditionnements dont des défauts ont été mis en évidence. Il appartient aux agences du médicament d'en vérifier la bonne réalisation et d'être globalement plus exigeantes, sans se satisfaire de rénovations de façade qui laissent des failles béantes dans la sécurité des soins.
Synthèse élaborée collectivement par la Rédaction
sans aucun conflit d'intérêts
©Prescrire