Résumé
En 2021, Prescrire a analysé 190 conditionnements de médicaments. Le bilan est nuancé, avec quelques signaux de progrès mais des défauts qui persistent ou se répètent.
Concernant la mention d'une dénomination commune internationale (DCI) bien visible sur les boîtes, le contraste reste important entre les médicaments autorisés par voie européenne centralisée et ceux ayant fait l'objet d'une autorisation de mise sur le marché (AMM) française seulement. Sur les boîtes de ces derniers, trop souvent la mention de la DCI est minimisée, avec une large mise en avant du nom commercial.
Avec certains médicaments, les informations utiles au patient pour une prise correcte du médicament sont présentes sur la boîte, ce qui facilite la transmission d'informations aux patients dès la dispensation.
Le passage de présentations de comprimés ou gélules en flacon-vrac à des présentations en plaquettes unitaires reste exceptionnel. Parmi les spécialités récemment autorisées, les présentations en plaquettes unitaires prédécoupées sont malheureusement rares.
De nouveaux médicaments buvables en flacon multidoses ont été commercialisés avec une seringue orale graduée, un dispositif adapté pour mesurer les doses. Mais beaucoup d'anciens médicaments buvables n'ont connu aucune évolution de leur dispositif doseur, qui reste imprécis.
Des présentations prêtes à l'emploi de médicaments injectables sont une aide pour les patients et les soignants. Diverses dérogations temporaires au droit européen ont été appliquées aux flacons multidoses de vaccins utilisés lors des campagnes vaccinales contre la pandémie de covid-19.
La mise à disposition de conditionnements de qualité dès la commercialisation est cruciale pour sécuriser les soins. Pour les firmes et les agences, porter une attention particulière au conditionnement dès le stade du dossier d'autorisation de mise sur le marché (AMM) devrait être un impératif.
Le conditionnement d'un médicament contribue de façon importante à la qualité des soins et à la sécurité des patients et de leur entourage.
En 2021, Prescrire a analysé le conditionnement de 190 spécialités pharmaceutiques. Des progrès ont été observés, y compris pour certaines spécialités déjà sur le marché, mais de nouvelles spécialités ont été commercialisées avec des conditionnements de mauvaise qualité, parfois source de danger. Certaines spécialités commercialisées depuis plusieurs années n'ont toujours pas vu d'évolution de leur conditionnement, pourtant nécessaire pour réduire les risques pour les patients.
Des décisions des firmes et des agences ont même parfois contribué à des régressions, accroissant l'insécurité dans les soins.
Affichage des DCI sur la boîte : pas toujours bien visible
L'identification d'un médicament commence la plupart du temps par sa boîte qui présente des caractéristiques (taille, couleurs, graphismes) et des informations spécifiques (notamment le ou les dénominations qui y figurent). Une mise en avant de chaque dénomination commune internationale (DCI), le vrai nom des médicaments, permet la bonne identification des substances qu'ils contiennent.
Les DCI sont bien visibles sur des boîtes de spécialités dont l'autorisation de mise sur le marché (AMM) provient de la procédure européenne centralisée. C'est le cas par exemple de Remsima° (infliximab).

Remsima° (infliximab) stylo injectable
Sur les boîtes d'autres spécialités dont le conditionnement a été analysé par Prescrire en 2021, les DCI sont peu lisibles, avec une nette mise en avant du nom commercial. Un grand nombre de ces spécialités ont été commercialisées en France à la suite d'une AMM par procédure nationale, délivrée par l'Agence française du médicament (ANSM). Parmi elles figure par exemple Rhinofebral jour et nuit° (paracétamol + acide ascorbique + maléate de phéniramine).

Rhinofebral jour et nuit° (paracétamol
+ acide ascorbique + maléate de phéniramine)
Cela concerne aussi trois copies de collyres analysées par Prescrire en 2021 : Brimazed° (brimonidine), Costec° (dorzolamide + timolol), Todexal° (tobramycine + dexaméthasone).
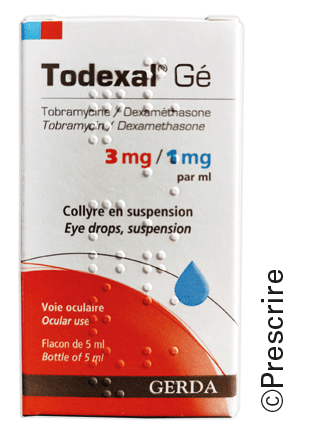
Todexal° (tobramycine + dexaméthasone)
D'une façon générale, le nom commercial d'une association à doses fixes a l'inconvénient de faire oublier sa composition multiple (1).
Dans le cas particulier des médicaments inhalés, une mise en avant du nom commercial du dispositif inhalateur, en complément du nom commercial de la spécialité, expose à des erreurs. En effet, des confusions sont possibles entre les diverses spécialités dont les compositions diffèrent mais qui intègrent le même dispositif inhalateur (2).
Le conditionnement primaire : un élément protecteur à plus d'un titre
Le conditionnement primaire est directement au contact du médicament. Il constitue, en complément de la boîte, un support d'informations indispensables à l'identification du médicament et à son bon usage. En effet, sorti de sa boîte, tout médicament devrait rester facilement identifiable. Le conditionnement primaire contribue aussi à la protection de l'entourage des patients, notamment quand il dissuade des personnes vulnérables, comme les enfants, d'avaler le médicament.
Flacons-vrac : trop nombreux encore
En 2021, de trop nombreuses formes orales sèches de médicaments sont encore présentées en flacon-vrac. L'identification de ces formes orales une fois sorties du flacon, par exemple pour remplir un pilulier hebdomadaire, devient souvent impossible. De plus, la présentation en flacon-vrac expose à des dangers, notamment à des intoxications accidentelles d'enfants après renversement du contenu du flacon, ou à l'exposition de l'entourage à des cytotoxiques, tels Ayvakyt° comprimés (avapritinib) et Vitrakvi° gélules (larotrectinib) (3,6).
Plaquettes unitaires, le meilleur choix
Les plaquettes unitaires prédécoupées sont le conditionnement primaire de premier choix des formes orales sèches telles que les comprimés ou les gélules (7). La mention au dos de chaque alvéole de la DCI, du nom commercial, du dosage, du numéro du lot et de la date de péremption est indispensable pour assurer la bonne identification du médicament en cas de découpage de la plaquette. Parmi les spécialités analysées en 2021, trop peu encore sont présentées en plaquettes unitaires prédécoupées.
La commercialisation d'une copie est l'occasion de fournir un conditionnement de meilleure qualité que celui du princeps. C'est le cas des comprimés de Défériprone Arrow°, présentés en plaquettes unitaires alors que ceux du princeps Ferriprox° demeurent en flacon-vrac.
De même, la copie Hydrochlorothiazide Arrow° en comprimés dosés à 12,5 mg est disponible à l'hôpital en plaquettes unitaires prédécoupées ; mais, pour les patients de ville, seuls des comprimés dosés à 25 mg et présentés en plaquettes comportant les mentions imprimées de manière aléatoire sont disponibles.
Parfois, une firme choisit d'améliorer le conditionnement d'un médicament déjà commercialisé, comme c'est le cas pour la spécialité Imbruvica° (ibrutinib), qui était auparavant présentée en gélules contenues dans un flacon-vrac ; les comprimés sont désormais présentés en plaquettes.
Des plaquettes mal conçues
Les plaquettes ne sont pas toujours conçues pour assurer la bonne identification du médicament et limiter le risque d'erreur. Quand les mentions sur la plaquette sont disposées de manière aléatoire, à la façon d'un papier peint, le découpage des alvéoles fait disparaître les mentions utiles comme dans le cas de Cariban° (doxylamine + pyridoxine).
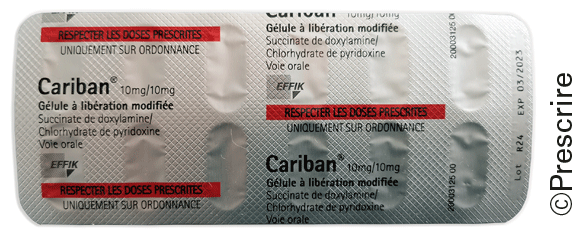
Cariban° (doxylamine + pyridoxine)
Parfois, le prédécoupage des plaquettes est une source d'erreur. Ainsi, la portion prédécoupée des gélules de Nubeqa° (darolutamide) contient 4 comprimés dosés chacun à 300 mg avec une seule mention commune indiquant "Nubeqa° 300 mg". Cela expose à des surdoses par la prise de 4 comprimés au lieu d'1 seul pour atteindre 300 mg (3).
Associer praticité et sécurité
Les conditionnements doivent être conçus pour faciliter l'emploi du médicament, mais sans nuire à la sécurité des patients et de leur entourage.
Une évolution tardive mais bienvenue d'un conditionnement pour limiter les confusions
Le vaccin à rotavirus Rotarix° en suspension buvable a fait l'objet d'injections par voie intramusculaire ou sous-cutanée. Ces erreurs ont été occasionnées par la forme de seringue de l'applicateur buccal. En 2021, après 15 ans de commercialisation en France, la seringue a été enfin remplacée par un tube souple contenant la suspension buvable.
Éviter des calculs de conversion avec des seringues doseuses graduées en milligrammes
La majorité des médicaments buvables présentés en flacon analysés par Prescrire en 2021 et récemment autorisés sont fournis avec une seringue-orale qui permet une mesure précise de la dose. Mais, aucune de ces seringues n'est graduée en milligrammes. Les graduations en milligrammes offrent pourtant l'avantage d'éviter les calculs de conversion quand les concentrations des solutions sont différentes de 1 mg/ml.
Pour Fintepla° (fenfluramine) et Fycompa° (pérampanel), la seringue orale est graduée en millilitres, alors que pour Tiorfan° (racécadotril), les graduations sont en kilos de poids de l'enfant, ce qui fait perdre de vue la quantité de substance administrée.
Des progrès sont à noter, comme avec Loxapac° (loxapine), dont la seringue orale graduée en millilitres a été remplacée par une seringue graduée en milligrammes. Au contraire, on observe parfois des régressions, comme avec la seringue doseuse de la spécialité Rovalcyte° (valganciclovir), désormais graduée en millilitres (3).
Des dispositifs doseurs peu précis ou absents
Certaines copies reproduisent les défauts de leur princeps, telle la spécialité Aripiprazole Arrow°, dont les dispositifs doseurs ressemblent à ceux du princeps : un compte-gouttes à poire et un gobelet doseur, tous deux imprécis et gradués en millilitres. Pour Vitrakvi° (larotrectinib) en solution buvable, aucun dispositif doseur n'est fourni, ce qui est d'autant plus inacceptable qu'il s'agit d'un antitumoral dont les manipulations devraient être protégées (3).
Pour de nombreux médicaments buvables autorisés depuis de nombreuses années en France, nos analyses ont constaté de trop lentes évolutions des dispositifs doseurs. En 2021, ceux de Biocalyptol°, Biocalyptol sans sucre° et Pholcodine Biogaran°, des sirops contenant de la pholcodine, consistent le plus souvent en un gobelet gradué en millilitres, un dispositif doseur imprécis. Celui de Dimétane sans sucre° (pholcodine) est une cuillère à double cuilleron (partie creuse), l'un d'une capacité de 2,5 ml et l'autre de 5 ml, ce qui expose aussi à des erreurs.
Flacons avec compte-gouttes : trop imprécis
En 2021, trop de spécialités sont encore conditionnées en flacon compte-gouttes, avec parfois des solutions très concentrées particulièrement dangereuses en cas de manipulation erronée ou d'intoxication, comme le tramadol ou certains neuroleptiques (8,9). Si les flacons avec compte-gouttes permettent parfois l'administration de faibles doses, utiles en pratique pour l'instauration ou l'arrêt progressif du traitement, ils demeurent des dispositifs imprécis, sujets à des erreurs de manipulation ou de comptage pour les fortes doses.
L'évolution chaotique du conditionnement de la solution buvable Laroxyl° (amitriptyline) illustre comment un effort de la firme pour sécuriser les soins s'est soldé par un échec. Le remplacement en 2021 du flacon compte-gouttes par un flacon accompagné d'une seringue doseuse graduée en milligrammes, justifié par la firme pour « améliorer le bon usage et diminuer le risque d'erreurs médicamenteuses », était un progrès. Mais la première graduation de 10 mg de la seringue, en adéquation avec la posologie prévue dans le résumé des caractéristiques (RCP), ne permet pas de mesurer des doses inférieures, qui sont parfois utiles en pratique de soins. Ce défaut a conduit la firme à remettre sur le marché le flacon compte-gouttes, alors qu'il expose à des erreurs de doses liées au comptage des gouttes. Cependant, des mentions plus claires qu'auparavant sont apparues sur la boîte quant aux correspondances entre gouttes et milligrammes de substance (10).
Des seringues et stylos bien conçus
Certaines spécialités examinées en 2021 disposent de conditionnements prêts à l'emploi, comme Entyvio° (védolizumab) et Remsima° (infliximab) autorisés en seringues et stylos préremplis pour injections sous-cutanées.
Des copies du pegfilgrastim (Cegfila° ; Nyvepria°) et du tildrakizumab (Ilumetri°) ont aussi été récemment autorisées en seringues préremplies. Sur les boîtes et les étiquettes des conditionnements de ces spécialités, les DCI et les dosages sont visibles, et un système de protection de l'aiguille après injection a été prévu pour éviter des blessures accidentelles.
La présentation d'Apokinon° (apomorphine) en cartouches apporte un progrès. Les cartouches sont à insérer dans la pompe Crono PAR°, évitant de remplir le réservoir avec une seringue et une aiguille (11).
Mais parfois, des défauts diminuent l'intérêt des conditionnements de médicaments sous forme injectable pourtant prêts à l'emploi.
Absence de sécurisation de l'aiguille
Les seringues préremplies de Takhzyro° (lanadélumab) ne disposent pas de système de protection de l'aiguille après injection pour protéger des blessures accidentelles (12).
Un nom de marque trompeur
Au sein de la gamme de stylos d'insuline lispro avec du tréprostinil et du citrate de sodium comme excipients (Lyumjev°), les stylos préremplis contenant la solution dosée à 100 unités par ml sont curieusement dénommés Lyumjev° Junior Kwikpen alors que ce médicament n'est pas autorisé chez l'enfant. La mention insuline lispro est visible sur les éléments du conditionnement, sans précision des excipients, alors que, selon la firme, ceux-ci réduisent le délai d'action de cette insuline (13). Des confusions avec d'autres insulines lispro, par exemple celles de la gamme Humalog° et qui ne contiennent pas ces excipients, sont possibles.
Nouveau dosage à risque de confusions avec l'ancien
De nouveaux dosages d'énoxaparine (Lovenox° 12 000 unités et 15 000 unités anti-Xa) ont été commercialisés en seringues préremplies avec des concentrations de 15 000 unités par ml alors que les autres dosages de la gamme ont par ailleurs une concentration à 10 000 unités par ml. Au sein de la gamme Lovenox°, pour un même volume de 0,8 ml, certaines seringues contiennent donc 8 000 unités, et d'autres 12 000 unités. De même, pour un même volume de 1 ml, certaines seringues contiennent 10 000 unités et d'autres 15 000 unités. La prescription de la dose en millilitres sur l'ordonnance expose à des erreurs avec des conséquences potentiellement graves. Il n'y a pas d'avertissement sur les risques liés à cette nouvelle concentration sur les éléments du conditionnement des nouveaux dosages de Lovenox°. Les seringues sont graduées en milligrammes et en millilitres et les posologies du RCP sont exprimées en unités anti-Xa et en milligrammes (14).
Attention aux seringues avec sur-remplissage
Les seringues préremplies de Eylea° (aflibercept) présentent un sur-remplissage destiné à éliminer l'air présent dans l'aiguille. Il est nécessaire d'aligner précisément le piston de la seringue préremplie sur le repère de la dose à administrer avant l'injection intravitréenne. Des élévations de la pression intraoculaire ont été plus fréquemment rapportées avec les seringues préremplies commercialisées en 2021 qu'avec la solution injectable à prélever à la seringue dans un flacon. Ces effets indésirables ont été attribués à des erreurs de manipulation, notamment par défaut d'alignement du piston sur le repère et injection du volume résiduel lié au sur-remplissage contenu dans la seringue préremplie (15).
En somme : améliorer les conditionnements des médicaments est une pressante nécessité
L'analyse des conditionnements des spécialités présentées dans Prescrire en 2021 aboutit une nouvelle fois à un bilan en demi-teinte, avec des améliorations tangibles et des défauts importants et malheureusement récurrents.
Trop souvent, il faut attendre que des erreurs soient rapportées aux agences après commercialisation pour qu'un conditionnement soit enfin amélioré. Pourtant, la conception d'un conditionnement de médicament est une étape importante qui doit être soigneusement réfléchie et évaluée, et ce bien avant la commercialisation, en prenant en compte notamment les pratiques des soignants, les erreurs observées au cours des essais cliniques et en anticipant les difficultés qui seront rencontrées par les patients (16).
Il est dans l'intérêt des patients d'obtenir des firmes la conception de conditionnements de qualité assurant leur sécurité. Il est aussi dans leur intérêt que les agences du médicament prennent davantage en compte la qualité des conditionnements lors de leurs évaluations et autorisations.
Synthèse élaborée collectivement par la Rédaction
sans aucun conflit d'intérêts
©Prescrire