Résumé
Parmi les 190 conditionnements de médicaments analysés par Prescrire en 2020, trop peu encore répondent aux exigences de qualité et de sécurité nécessaires aux soins. Certaines caractéristiques sont utiles à connaître afin de prévenir les erreurs et d'aider les patients à bien utiliser leurs médicaments.
Pour bien identifier le médicament, il est important que la DCI (dénomination commune internationale) des substances médicamenteuses soit très visible sur les différents éléments du conditionnement. Le choix d'un nom de fantaisie plutôt qu'un nom comportant la DCI nuit à cette identification. En 2020, la visibilité de certaines DCI n'a pas été améliorée lors d'occasions telles que : évolutions du conditionnement de médicaments anciens, changements de nom ou de composition.
Le risque d'erreurs lié à la forme pharmaceutique ou au rythme d'administration est parfois limité par certains éléments du conditionnement, comme des mentions d'avertissement sur la boîte, ou la présence de dispositifs doseurs adaptés aux posologies recommandées.
Il est important aussi de vérifier la présence de dispositifs de sécurité protégeant les patients, leur entourage et les soignants : par exemple un système de protection de l'aiguille pour les médicaments injectables ou encore un bouchon-sécurité sur les flacons multidoses.
Connaître les principales caractéristiques du conditionnement d'un médicament est utile pour choisir entre plusieurs spécialités contenant la même substance, y compris sous une même forme pharmaceutique, et ainsi pour le prescrire, le dispenser ou l'administrer aux patients avec beaucoup de sécurité.
En 2020, Prescrire a analysé le conditionnement de 190 spécialités pharmaceutiques, ce qui porte à plus de 7 500 le nombre de conditionnements analysés depuis 1981. Le bilan annuel du conditionnement est l'occasion de mettre en avant certaines améliorations et certains défauts persistants des conditionnements. C'est aussi l'occasion de présenter des particularités pour aider les soignants à choisir les médicaments les plus adaptés aux soins et aider les patients à profiter de leur efficacité sans trop de dangers.
Encore de nombreux obstacles à l'identification correcte des médicaments
Afin de bien identifier un médicament, des mentions claires sur les divers éléments du conditionnement (boîte, plaquette, flacon, etc.), en particulier la dénomination commune internationale (DCI) et le dosage de la (ou des) substance(s) médicamenteuse(s) qu'il contient, aident à la compréhension et limitent le risque d'erreurs.
Repérer la DCI sur les boîtes : toujours aussi difficile tant les noms de fantaisie sont mis en valeur
Une bonne identification des substances médicamenteuses est un élément de la sécurité des soins. Des erreurs liées à la présentation des mentions présentes sur le conditionnement des médicaments sont régulièrement rapportées à l'Agence française du médicament (ANSM), notamment des confusions entre substances médicamenteuses du fait de conditionnements primaires (plaquette, flacon, etc.) ou de boîtes se ressemblant (1).
Pourtant, pour près de la moitié des conditionnements analysés en 2020 par Prescrire, le nom de fantaisie est mis en valeur sur la boîte et le conditionnement primaire, au détriment de la DCI.
La spécialité Flector° comprimés (diclofénac), est un exemple de DCI minimisée au profit du nom de fantaisie sur la boîte et sur la plaquette. Au contraire, la DCI est bien visible sur certains autres conditionnements de médicaments, tel Kipos° (colécalciférol).
Parmi les copies avec un nom de fantaisie, les spécialités Elfasette° (désogestrel), Lolistrel° et Lolistrel continu° (lévonorgestrel + éthinylestradiol) ont sur leur conditionnement des DCI minimisées par rapport au nom de fantaisie, fortement mis en avant. Il s'agit d'une régression puisque, auparavant, les spécialités Elfasette° et Lolistrel° étaient commercialisées sous un nom commercial comportant la DCI suivie du nom de la firme, Mylan. Il restait pourtant possible de rendre la DCI très visible sur le conditionnement, comme l'a fait la firme Pierre Fabre Dermatologie sur la boîte et les plaquettes d'Alizem°, une autre copie qui contient de l'alitrétinoïne.

Pour d'autres médicaments, le nom commercial a été modifié, comme Normacol° devenu Normafibe° (sterculia) mais sur le conditionnement, la DCI est restée minuscule.
Des spécialités destinées à des voies d'administration autres que la voie orale ont encore trop souvent des mentions de DCI minimisées. C'est le cas des spécialités Vablys° (chlorure de déqualinium) et Mycohydralin° (clotrimazole) pour la voie vaginale et de Plitican° (alizapride) injectable.
Sur les boîtes de suppositoires Coquelusédal nourrissons°, Coquelusédal enfants° (extraits hydroalcooliques mous de grindélia et de gelsémium) et Coquelusédal adultes° (extraits hydroalcooliques mous de grindélia et de gelsémium + huile essentielle de niaouli) le nom commercial est mis en valeur, les DCI n'apparaissant clairement que sur les côtés, qui détaillent la composition. C'est encore moins clair pour les plaquettes des suppositoires sur lesquelles figurent seulement la mention de la population concernée et le nom commercial, sans DCI.
Les collyres Vizilatan° (latanoprost) et Vizitrav° (travoprost) ont des noms commerciaux proches et des chartes graphiques ressemblantes, exposant à un risque de confusion. En cas de rangement par ordre alphabétique du nom commercial, ces boîtes seront potentiellement placées côte à côte dans les tiroirs de certaines officines. Une meilleure visibilité de leur DCI sur les conditionnements contribuerait à limiter le risque de confusion lors du rangement et de la dispensation (2).
Trop de plaquettes non unitaires qui font perdre des mentions essentielles
Les plaquettes de médicaments constituent un support d'identification important, en particulier quand elles sont sorties de leur boîte, voire découpées pour préparer les doses dans un pilulier. Les plaquettes unitaires prédécoupées permettent une meilleure identification du médicament car les mentions utiles (DCI, nom commercial, numéro de lot et date de péremption) figurent sur chaque alvéole et restent ainsi visibles même après découpage de la plaquette (3).
Une impression des mentions sur le film des plaquettes déconnectée de l'emplacement des alvéoles, à la manière d'un papier peint, complique voire rend impossible l'identification de leur contenu en cas de découpage. C'est le cas pour les spécialités Alunbrig° (brigatinib), Flector° comprimés (diclofénac), Lumirelax° (méthocarbamol), Prontadol° (paracétamol + caféine), Santuril° (probénécide), Slenyto° (mélatonine), Tillhepo° (acide ursodésoxycholique) et Twicor° (rosuvastatine + ézétimibe). Quant à mettre sur le marché une plaquette prédécoupée telle que celle de Colpermin° (huile essentielle de menthe poivrée), recouverte de mentions sans rapport avec le prédécoupage, c'est un non-sens !
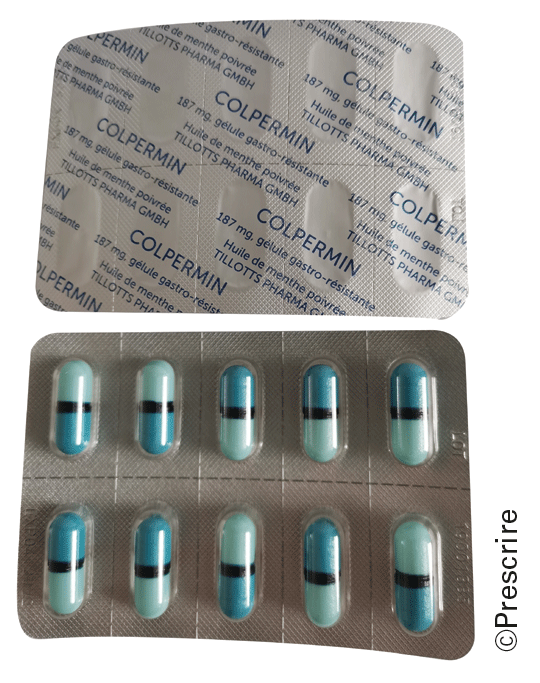
Plaquettes prédécoupées de Colpermin° (huile essentielle de menthe poivrée) : les mentions ne sont pas alignées sur les traits de découpe
Sur d'autres plaquettes, l'apposition des mentions laisse penser qu'il s'agit de conditionnements unitaires, mais c'est un leurre : les alvéoles ne sont pas disposées en regard des mentions, ce qui compromet l'identification de ces mentions utiles en cas de découpage. C'est le cas des spécialités Carvecoral° (ivabradine + carvédilol), Rinvoq° (upadacitinib) et Suvreza° (ézétimibe + rosuvastatine).
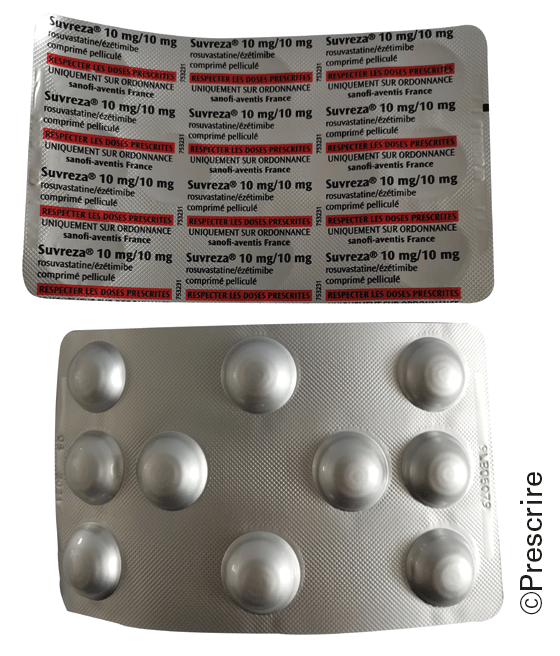
Suvreza° (ézétimibe + rosuvastatine) : la disposition des mentions sur une face de la plaquette ne correspond pas aux emplacements des alvéoles sur l'autre face
En 2020 encore, des spécialités analysées sont présentées en plaquettes unitaires prédécoupées : Diphante° (phénytoïne), Forxiga° (dapagliflozine) et la boîte de 2 capsules de Kipos° (colécalciférol) ; mais elles font figure d'exceptions.
Associations à doses fixes : attention aux différentes combinaisons de dosages
On appelle association à doses fixes un médicament contenant plusieurs substances médicamenteuses dans une même forme pharmaceutique. Les associations à doses fixes avec un nom de fantaisie font particulièrement perdre de vue leur composition, en masquant aux yeux des patients et des soignants le fait qu'elles contiennent plusieurs substances. Ces associations à doses fixes sont parfois plus pratiques pour les patients, en réduisant le nombre d'unités de prise, à condition qu'elles associent des substances dont l'intérêt clinique est démontré pour chacune et que les différents dosages choisis soient cohérents (4).
Des mentions claires de chacune des DCI, directement suivies du dosage correspondant, sur tous les éléments du conditionnement assureraient une identification correcte de ces associations. La commercialisation de plusieurs combinaisons de dosages expose à un risque de confusion entre les dosages, et à des erreurs au moment de la prescription, du rangement à la pharmacie, de la dispensation, puis lors de l'administration ou de la prise par le patient (5).
Pour les spécialités Carvecoral° (carvédilol + ivabradine), Orkambi° (lumacaftor + ivacaftor) et Twicor° (rosuvastatine + ézétimibe), les combinaisons de dosages sont bien visibles sur les boîtes, et les éléments graphiques aident à les différencier. Par contre, les plaquettes des différentes combinaisons de dosages au sein des gammes Carvecoral° et Twicor° s'avèrent très difficiles à distinguer, ce qui expose à des erreurs quand elles sont isolées de leur boîte. Les sachets des deux combinaisons de la gamme Orkambi° sont eux aussi très ressemblants.
Pour la spécialité Preminor° (ramipril + amlodipine), les boîtes des différentes combinaisons de dosages sont elles aussi ressemblantes, et la mention de la DCI amlodipine, en bleu clair sur fond blanc, est trop discrète. Les plaquettes sont étiquetées façon "papier-peint", sans distinguer les combinaisons de dosages (6).
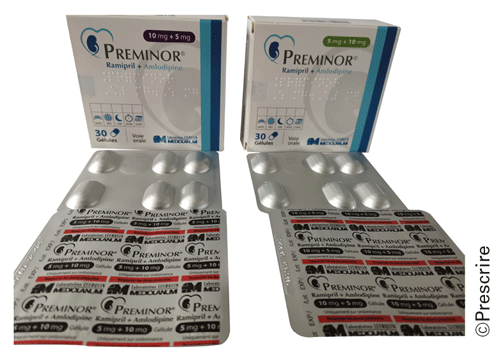
Preminor° (ramipril + amlodipine) : les plaquettes trop ressemblantes favorisent la confusion entre les combinaisons de dosages (ici, 2 combinaisons inverses : 10 mg + 5 mg ; 5 mg + 10 mg)
Associer praticité et sécurité pour limiter le risque d'erreur
Quand un médicament nécessite une mesure précise de la dose ou qu'il a une posologie particulière (une périodicité d'administration hebdomadaire par exemple), il est important que le conditionnement sécurise autant que possible son utilisation.
Des dispositifs doseurs souvent inadaptés exposant à des erreurs de dose
Pour les médicaments buvables présentés en flacon multidoses, l'ANSM a recommandé en 2016 que « le dispositif d'administration fourni [soit] gradué dans la même unité que celle de la posologie recommandée dans le RCP [résumé des caractéristiques du produit] et la notice ». Le plus souvent, dans les RCP et les notices, la posologie est exprimée en quantité pondérale (par exemple milligrammes (mg)) (7).
Les dispositifs doseurs de la spécialité Amglidia° (glibenclamide, un sulfamide hypoglycémiant) autorisée dans le diabète néonatal, sont des seringues orales graduées en millilitres (ml) alors que la posologie est exprimée en milligrammes dans la notice et le RCP. La notice ne comporte pas de tableau pour faciliter la conversion en millilitres de la dose prescrite en milligrammes. Or ce médicament est autorisé avec deux concentrations variant d'un facteur 10 (respectivement 0,6 mg/ml et 6 mg/ml). Deux présentations sont commercialisées pour chaque concentration : l'une dont la boîte contient une seringue de contenance 1 ml et l'autre dont la boîte contient une seringue de 5 ml. Toutes ces différences sont autant de sources de confusions et d'erreurs de doses.
De même, la boîte d'Epidyolex° (cannabidiol), autorisé dans certaines formes graves d'épilepsie de l'enfant, contient deux types de seringues orales de contenances différentes. L'utilisation de la seringue de plus grande contenance pour mesurer des volumes de moins de 1 ml entraîne des imprécisions. Ces seringues sont de plus graduées en millilitres alors que la posologie est exprimée en milligrammes dans le RCP pour cette solution dosée à 100 mg/ml. Là non plus, la notice ne comporte pas de tableau de conversion (8).
La boîte de la solution buvable Tussonyl° (oxomémazine) contient un gobelet doseur, dispositif imprécis, gradué tous les 5 ml jusqu'à 20 ml. La dose maximale d'oxomémazine dans le traitement de la toux est de 10 ml par prise pour les adultes et les enfants pesant au moins 20 kg ; les graduations 15 ml et 20 ml sont donc superflues. La prise d'un gobelet complet expose à une surdose, augmentant le risque de somnolence et de survenue d'effets indésirables avec cet antihistaminique H1 sédatif et atropinique qui a aussi des propriétés neuroleptiques (9).
À la suite du signalement d'erreurs liées à la disparité entre les dispositifs doseurs (seringue orale et compte-gouttes) des présentations d'halopéridol (Haldol° ou autre) en solution buvable, la commercialisation de la présentation avec seringue orale d'Haldol° a été arrêtée. Mais le choix de maintenir uniquement la présentation avec compte-gouttes n'a pas résolu le problème posé par la confusion entre nombre de gouttes et milligrammes, lui aussi à l'origine d'erreurs de dose.
A contrario, une évolution positive a été repérée en 2020 : l'ajout dans la boîte de la solution buvable Tiapridal° (tiapride), un neuroleptique, d'une seringue doseuse graduée en milligrammes sur laquelle figurent la DCI et la concentration de la solution. C'est un réel progrès pour cette spécialité auparavant présentée en flacon compte-gouttes (6).
Rendre visible la périodicité d'administration particulière de certains médicaments
La périodicité d'administration particulière de certains médicaments est un élément important à connaître pour les soignants et les patients. Des mentions spécifiques visibles sur les éléments du conditionnement, à savoir la boîte, le conditionnement primaire (plaquette, étiquette d'un stylo prérempli ou d'un flacon) et la notice contribuent à limiter le risque d'erreurs de périodicité d'administration (10).
Aucune mention de la périodicité d'injection hebdomadaire ne figure sur la boîte de Prexate° (méthotrexate), une spécialité autorisée dans certaines maladies auto-immunes. Pourtant, le Comité européen de pharmacovigilance (PRAC) a recommandé que le rythme hebdomadaire d'injection soit indiqué sur les conditionnements des spécialités contenant du méthotrexate autorisé comme immunodépresseur, afin de limiter les risques d'injections quotidiennes, erreurs parfois mortelles lorsqu'elles ne sont pas détectées à temps. Ces recommandations ont été entérinées par la Commission européenne fin 2019 (6,10).
À l'opposé, pour Ozempic° (sémaglutide), un hypoglycémiant, la mention "une fois par semaine" est bien visible sur la face principale et sur 2 des côtés de la boîte, sur l'étiquette du stylo et sur le rabat de la boîte. Celui-ci comprend un cadre pour noter le jour choisi pour l'injection et des cases pour noter les dates d'injection effectives. L'ensemble de ces éléments est utile au bon usage de ce médicament (11).

Le rabat de la boîte d'Ozempic° (sémaglutide) comporte des espaces pour préciser le jour de la semaine prévu pour les injections et noter les dates effectives d'injection
Attention aux médicaments à marge thérapeutique étroite
Les présentations de formes buvables en unidoses limitent le recours aux dispositifs doseurs nécessitant une étape de mesure, voire des calculs de conversion quand le dispositif n'est pas gradué dans la même unité que celle de la posologie du RCP.
La présentation en unidoses buvables de Tsoludose° (à base de lévothyroxine) est une alternative aux nombreuses présentations en comprimés de cette hormone thyroïdienne. Mais l'opacité de la dosette de cette spécialité (car la lévothyroxine est à protéger de la lumière) ne permet pas de vérifier que la totalité de la solution buvable a bien été extraite, alors que la lévothyroxine est un médicament à marge thérapeutique étroite. D'après la notice, presser la dosette au moins 5 fois lors de l'absorption de son contenu permet de considérer qu'elle est correctement vidée (12).
Protéger des risques d'intoxication ou de blessure accidentelles
La sécurité lors de l'utilisation des médicaments concerne les patients mais aussi leur entourage, les aidants et les soignants. Si le médicament présente un risque d'intoxication en cas d'ingestion accidentelle ou de blessure lors des manipulations, son conditionnement doit être adapté et protéger tous les intervenants.
Le flacon-vrac : un conditionnement qui perdure malgré les risques d'intoxication
Contrairement aux formes orales sèches conditionnées en plaquettes unitaires prédécoupées, les flacons-vrac compliquent l'identification du médicament quand les comprimés ou gélules sont placés dans un pilulier.
De plus, ils exposent à une dissémination de leur contenu par maladresse. Ils augmentent le risque d'une prise accidentelle par une autre personne que le patient, en particulier un enfant. Même les flacons munis d'un bouchon-sécurité ne protègent pas totalement contre ce danger. En 2020, de trop nombreux médicaments sont encore conditionnés en flacons-vrac, bien qu'ils soient parfois dangereux en faible quantité. C'est le cas de certains cytotoxiques : Imeth° comprimés à 10 mg (méthotrexate), Rubraca° (rucaparib) et Talzenna° (talazoparib) (6).
D'autres médicaments sont aussi présentés en flacons-vrac : Cernitol° (extraits de pollens) autorisé dans l'hypertrophie bénigne de la prostate ; Delstrigo° (doravirine + lamivudine + ténofovir disoproxil), Dovato° (dolutégravir + lamivudine) et Pifeltro° (doravirine), des antirétroviraux autorisés dans le traitement du HIV ; Kigabeq° (vigabatrine) et Lamictal° 5 mg (lamotrigine), des antiépileptiques. C'est une régression pour ce dernier qui était auparavant conditionné en plaquettes (6).
Le bouchon-sécurité : un élément simple et protecteur trop souvent absent
En 2020, de nombreux médicaments sous forme liquide, pour bains de bouche ou destinés à la voie orale, étaient encore présentés en flacons sans bouchon-sécurité. C'est le cas pour des bains de bouche contenant de la chlorhexidine non associée : Chlorhexidine Arrow°, Chlorhexidine Biogaran°, Chlorhexidine Mylan°, Paroex°, Prexidine°, Eludrilperio°. Et c'est aussi le cas de la solution buvable Bonasol° (acide alendronique) et des sirops Fluisédal° (prométhazine + benzoate de méglumine + polysorbate 20) et Tussisédal° (prométhazine + noscapine) (6).
Pourtant, l'ajout d'un bouchon-sécurité est une solution simple pour limiter les risques liés à l'ingestion des médicaments par des enfants (13). Certains médicaments en solution buvable multidoses analysés en 2020 en sont ainsi équipés : Amglidia° (glibenclamide), un sulfamide hypoglycémiant ; Epidyolex° (cannabidiol), Haldol° (halopéridol) et Tiapridal° (tiapride), des neuroleptiques ; Tussonyl° (oxomémazine), un antihistaminique H1 utilisé dans la toux ; Zoryon° (méthadone), un opioïde fort. Pour Zoryon°, le risque d'effet indésirable grave voire mortel lié à l'ingestion du sirop, en particulier par un enfant, est d'ailleurs rappelé sur les boîtes et les étiquettes des flacons.
Le film-sécurité sur les plaquettes : une protection supplémentaire encore trop rarement utilisée
Renforcer la protection des enfants vis-à-vis du risque d'ingestion accidentelle par l'ajout d'un film-sécurité sur les plaquettes de comprimés ou gélules est bienvenu, notamment avec certaines substances particulièrement dangereuses.
Malheureusement, les copies Buprénorphine/Naloxone Arrow° et Buprénorphine/Naloxone Mylan° (buprénorphine + naloxone) sont présentées en plaquettes sans film-sécurité (6). C'est regrettable, d'autant que le princeps Suboxone° est quant à lui équipé de ce dispositif de sécurité (14).
La spécialité Zoryon° gélules (méthadone) est quant à elle présentée en plaquettes pourvues d'un film-sécurité, ce qui est bienvenu compte tenu du risque d'effets indésirables graves, voire mortels, en cas d'ingestion par un enfant, risque d'ailleurs rappelé sur les boîtes et plaquettes de ce médicament.
Un système de protection de l'aiguille après injection très souvent présent en prévention des blessures accidentelles
Pour protéger les patients, les aidants et les soignants des blessures accidentelles avec les médicaments injectables, de nombreuses spécialités sont équipées d'un système de protection de l'aiguille après injection. C'est le cas pour Dupixent° (dupilumab), Fasenra° (benralizumab), Pelgraz° (pegfilgrastim) présentés en seringues et stylos préremplis, et de Fulphila° (pegfilgrastim), Inhixa° (énoxaparine), Skyrizi° (risankizumab) et Tegsedi° (inotersen) en seringues préremplies.
À l'inverse, la spécialité Waylivra° (volanésorsen), présentée en seringues préremplies, n'est équipée d'aucun système de protection de l'aiguille.
En somme : parfois un critère de choix, parfois un élément d'insécurité
La connaissance du conditionnement est utile à divers titres : pour prescrire, parmi les spécialités contenant une même substance, celle dont le conditionnement est de meilleure qualité ; lors de la dispensation, pour aider les patients à utiliser au mieux les médicaments, y compris en ouvrant la boîte devant eux si nécessaire ; et aussi pour administrer les médicaments en toute sécurité.
Trop souvent encore en 2020, la DCI est minimisée au profit du nom de fantaisie sur les éléments du conditionnement. Et parmi les médicaments sous forme orale sèche analysés par Prescrire en 2020, seule une poignée sont présentés en plaquettes unitaires prédécoupées.
Pire encore, de nombreux médicaments toxiques en cas d'ingestion accidentelle, notamment par un enfant, sont conditionnés en flacons-vrac ou en plaquettes dépourvues de film-sécurité. De nombreuses formes liquides en flacons dépourvus de bouchon-sécurité persistent sur le marché.
Quelques éléments de sécurité sont à saluer, comme des mentions bien visibles qui avertissent le patient d'une posologie ou d'un rythme d'administration particuliers, ainsi que la présence quasi systématique d'un système de protection de l'aiguille après injection pour éviter les piqûres accidentelles.
Les recommandations émises par l'ANSM en 2018 concernant l'étiquetage des conditionnements des médicaments laissent espérer une évolution vers une identification plus claire des DCI, au moins pour les médicaments soumis à une autorisation de mise sur le marché par l'agence française dans le cadre d'une procédure nationale (1). Pour les firmes qui conçoivent et fabriquent les médicaments, et pour les agences qui les autorisent, il reste beaucoup à faire pour protéger les patients et leur entourage des dangers liés au conditionnement des médicaments.
Synthèse élaborée collectivement par la Rédaction
sans aucun conflit d'intérêts
©Prescrire