Résumé
En 2018, Prescrire a examiné le conditionnement de 220 spécialités pharmaceutiques. Depuis 1981, ce sont 7 000 conditionnements qui ont été analysés et le constat est sans appel : la plupart ne garantissent pas l'administration du bon médicament au bon dosage dans les contextes prévisibles d'utilisation. En cause : le manque de lisibilité sur les étiquetages de la dénomination commune internationale (DCI), vrai nom du médicament, et du dosage ; la rareté des présentations unitaires ; l'insuffisance des mentions protectrices dans les notices face aux nombreuses situations à risque.
Le renforcement en France en 2018 des normes sur les étiquetages par l'Agence française des produits de santé (ANSM), ses recommandations aux industriels d'arrêter les gammes ombrelles et d'opter pour des plaquettes unitaires, montrent enfin une prise davantage au sérieux des dangers des conditionnements inadéquats.
Préparation des doses à administrer, chimiothérapie orale à domicile, démarches de prévention ou d'interception des erreurs médicamenteuses et leur déclaration sont des pratiques de soins qui se développent. Elles révèlent les dangers de certains conditionnements.
Le conditionnement d'un médicament est un élément déterminant de sa balance bénéfices-risques. Sa fonction primordiale est l'identification de la composition du médicament. Il vise aussi à préserver le médicament de son environnement (chaleur, humidité, lumière). Il est censé limiter les erreurs médicamenteuses. Il est aussi censé protéger patients et professionnels de santé d'une toxicité liée à la manipulation du médicament. Et ce, à chaque étape du circuit de son utilisation : transport, stockage, dispensation, préparation des doses à administrer, administration, etc. Le conditionnement est aussi le support direct d'informations via ses étiquetages et sa notice, notamment sur la composition, les conditions d'utilisation, les interactions, les effets indésirables (1).
Parmi les déclarations d'erreurs médicamenteuses reçues par l'Agence française des produits de santé (ANSM) (plus de 12 000 de 2013 à 2017), on trouve surtout des erreurs avérées (survenues) dans 81 % des cas ; des erreurs interceptées avant l'administration (8 %) ; et des risques d'erreurs déduits d'observations témoignant d'un danger potentiel (11 %). 30 % des déclarations sont en lien avec les étiquetages (2,3).
Prescrire a analysé environ 7 000 conditionnements de médicaments depuis 1981, dont 220 en 2018. Les observations de dangers potentiels sont nombreuses. Les faits marquants de ces analyses sont cités dans les Palmarès Prescrire publiés chaque année en février et dans les bilans annuels du conditionnement (1). Voici le bilan 2018.
Recommandation par l'ANSM d'une meilleure lisibilité de la DCI, le vrai nom du médicament
Depuis 2018, l'étiquetage des comprimés et des gélules fait enfin l'objet d'un cadre normatif édicté par l'ANSM (a). En complément des vecteurs juridiques traditionnels (lois, décrets, arrêtés), l'ANSM exerce un rôle croissant avec la publication de recommandations nationales de bonnes pratiques et de sécurisation de l'utilisation des médicaments. Ces recommandations, par nature facultatives, sont cohérentes avec certaines dispositions du Code de la Santé publique. Elles définissent des normes considérées par l'autorité sanitaire comme le cadre de protection des patients à ne pas ignorer par les industriels.
Sécurisation des étiquetages : les industriels très au-dessous des enjeux
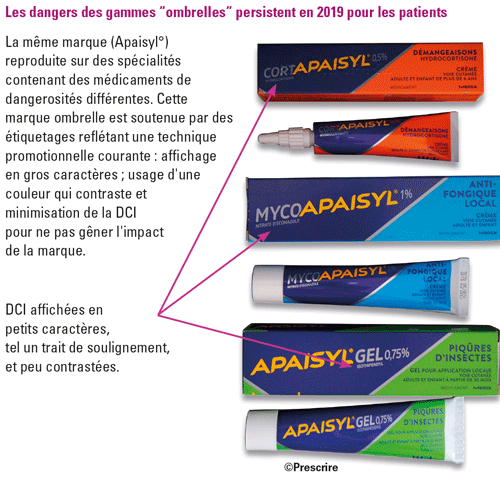
L'ANSM recommande de mettre en évidence sur les étiquetages des comprimés et gélules les mentions nécessaires : à l'identification du médicament, par sa dénomination commune internationale (DCI) et à son dosage ; à sa traçabilité (n° de lot). Elle recommande ainsi les plaquettes unitaires prédécoupées comme standard de sécurité. L'enjeu est de garantir l'administration du bon médicament à la bonne personne (lire l'encadré "C'est-à-dire ? Plaquettes unitaires prédécoupées et plaquettes non unitaires"). L'ANSM incite fortement les industriels à rendre moins visibles certaines informations qui ne sont pas en lien avec une utilisation sécurisée des médicaments : marques et logos, graphismes promotionnels banalisants tels qu'illustrations, dessins de plantes, de fruits, objets divers, etc.
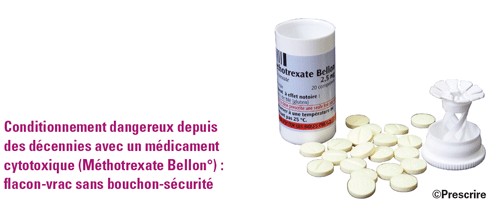
Les étiquetages feront-ils peau neuve en 2019 ? Dans l'attente, en 2018, comme chaque année, nous avons encore observé des étiquetages minimisant la DCI : Dicetel° (pinavérium) ; Nocertone° (oxétorone) ; Ginkor Fort° (Ginkgo biloba + heptaminol + troxérutine) ; Décontractyl° (méphénésine) ; Trolovol° (pénicillamine) ; Androgel° (testostérone). Les défauts de lisibilité des DCI décrits par Prescrire depuis des années sont désormais pointés du doigt aussi par l'ANSM : caractères et contrastes réduits au profit des marques et logos ; plaquettes non unitaires et peu lisibles. Quant aux flacons-vrac, ils ont encore représenté un quart des conditionnements de formes orales solides examinées par Prescrire en 2018. Par exemple : Efferalgan° comprimés orodispersibles (paracétamol) ; Méthotrexate Bellon° comprimés ; Ocaliva° (acide obéticholique) ; Procysbi° (mercaptamine) ; Tivicay° (dolutégravir). Des relecteurs de ce texte ont par ailleurs cité d'autres exemples : Purinethol° (mercaptopurine) ; Lanvis° (thioguanine) ; Vesanoïd° (trétinoïne) ; Epitomax° (topiramate) ; de nombreux antirétroviraux. La liste est longue. Or avec les flacons-vrac, le médicament n'est plus identifiable ni protégé une fois sorti du flacon (4).
Garantir l'administration du bon médicament à la bonne personne passe par :
des étiquetages qui, au fil du circuit du médicament, maintiennent l'intégrité et la lisibilité des mentions de DCI et de dosages, en les valorisant, comme Fluoxétine Biogaran°, Kanuma° (sébélipase alfa) ou Taltz° (ixékizumab) ;
la mise à disposition de présentations en plaquettes unitaires, par exemple : Emtricitabine + ténofovir disoproxil Mylan° ; Kisqali° (ribociclib) ; Ninlaro° (ixazomib) ; Orobupré° (buprénorphine) ; Zejula° (niraparib). Ces plaquettes unitaires évitent aux soignants d'avoir à déconditionner et reconditionner (lire l'encadré "Préparation des doses à administrer : trop de conditionnements inadaptés à cette pratique"), ce qui permet de garantir la conservation du médicament selon les conditions éprouvées par l'AMM.
Les recommandations de l'ANSM sur les étiquetages et celles relatives aux choix des noms commerciaux invitent les firmes à l'arrêt des gammes "ombrelles" qui cumulent trop de dangers : une seule marque est associée à plusieurs produits contenant différentes substances qui exposent à des risques différents ; les étiquetages sont rendus confus par des éléments commerciaux (logos, graphismes similaires), qui attirent l'œil du consommateur au détriment du libellé de la composition des produits (5). Mais, début 2019, ces dangers persistent sur le marché avec de nombreuses gammes "ombrelles" : Apaisyl°, Sédermyl°, Humex°, Clarix°, etc.
La DCI trop peu utilisée dans les notices
Les recommandations européennes stipulent « de ne pas utiliser de façon excessive le nom de fantaisie dans le texte de la notice » et orientent vers la formulation « ce médicament » ou l'utilisation du pronom « il » (6). Mais l'application de ces règles d'information sur la composition du médicament reste insuffisamment respectée par les firmes.
De manière générale, la notice commence par le nom commercial puis la DCI, qui en constituent le titre. Notre examen des notices révèle que ce titre valorise souvent la marque. Et la marque est souvent excessivement citée tout au long de la notice. Par exemple, la notice de Femi° (éthinylestradiol + norgestimate) mentionne environ 50 fois la marque et seulement 2 fois la composition en DCI. Celle de Vimpat° (lacosamide) mentionne environ 70 fois la marque, et une dizaine de fois la DCI. Dans la notice de Femi°, les DCI sont omises au premier chapitre, qui a pourtant pour fonction de présenter le médicament. Il faut attendre la fin du document pour lire une formulation claire de la composition des comprimés.
Trop de conditionnements pédiatriques inadaptés
En matière de conditionnement, une mauvaise pratique perdure : l'extension aux enfants de l'autorisation de mise sur le marché (AMM) d'un médicament initialement destiné aux adultes est octroyée sans adaptation du médicament à ces nouveaux patients (forme, conditionnement), au point de créer des dangers.
L'AMM du sévélamer en poudre pour suspension buvable (Renvela°), étendue aux enfants à partir de l'âge de 6 ans, nécessite des doses de 0,8 g ou 1,6 g ajustables par paliers respectifs de 0,4 g ou 0,8 g à mesurer, selon le RCP, à l'aide d'une coupelle ou d'une cuillère de 1 ml. Mais début 2019, en France, il n'est fourni aucun dispositif doseur avec le conditionnement du sachet à 2,4 g, les dosages à 0,8 g et 1,6 g ne sont pas disponibles, et aucun dosage à 0,4 g n'est autorisé dans l'Union européenne.
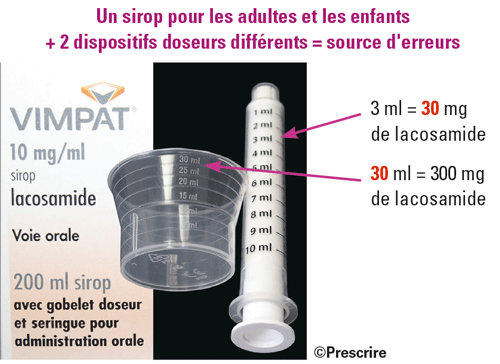
Avant l'extension de l'AMM du sirop Vimpat° (lacosamide à 10 mg/ml) aux enfants pesant moins de 50 kg, le sirop était fourni avec un gobelet de 30 ml destiné aux adultes et aux enfants de plus de 50 kg. Après l'extension de l'AMM aux enfants pesant moins de 50 kg, le conditionnement a évolué avec l'ajout d'une seringue orale de 10 ml. En 2019, la présentation "adultes" de Vimpat° fait donc aussi office de présentation "enfants", en regroupant deux dispositifs doseurs différents, ce qui est source de confusion. Leurs graduations en millilitres imposent toujours un calcul de conversion de la dose (prescrite en milligrammes), en millilitres de sirop à mesurer, source d'erreur de dose ici d'un facteur 10. La plupart des dispositifs doseurs analysés par Prescrire en 2018 étaient gradués en millilitres, tels Celsentri° (maraviroc), Kaletra° (lopinavir + ritonavir), Tamiflu° (oséltamivir).
Pour les enfants drépanocytaires, il serait prudent de fournir un dosage à 50 mg d'hydroxycarbamide (Siklos°), plutôt qu'un comprimé sécable à 100 mg. Cela permettrait notamment d'éviter des risques de cytotoxicité cutanée et de contamination de l'environnement par les débris dispersés lors de la cassure des comprimés. Pour mieux sécuriser, il serait utile de différencier davantage les étiquetages des dosages à 100 mg et à 1 000 mg d'hydroxycarbamide.
L'AMM d'Étiléfrine Serb° a été réorientée de l'hypotension orthostatique des adultes au traitement du priapisme, qui concerne aussi les enfants drépanocytaires. Mais le conditionnement n'a pas évolué : dosage inadapté aux enfants (il faut prélever le contenu d'une demi-ampoule) ; aucun matériel de préparation et d'injection n'est fourni ; les modalités d'auto-injection sont peu détaillées dans la notice.
En 2018, plusieurs médicaments, de dangerosités diverses, pour la plupart buvables, présentés en flacons-vrac sans bouchon-sécurité, ont encore été observés : Théralène° (alimémazine) ; Mucoplexil° (carbocistéine) ; Fluconazole Biogaran° ou autre ; Prozac° ou autre (fluoxétine) ; Panfurex° (nifuroxazide) ; Efferalgan° comprimés orodispersibles et Dolko° (paracétamol) ; A 313° (vitamine A). Pourtant, les solutions pour empêcher un enfant de goûter ou d'ingérer un médicament à l'insu de son entourage sont connues : bouchon-sécurité comme sur les flacons de Noyada° (captopril), Vimpat° (lacosamide), Triflucan° (fluconazole), etc. ; film anti-effraction comme sur les plaquettes d'Orobupré° (buprénorphine) ; cran de sécurité comme sur la boîte de Galafold° (migalastat).

Manipulation à domicile des antitumoraux oraux : des risques à prendre plus au sérieux
En 2019, l'accompagnement par les pharmaciens des patients atteints d'un cancer, traités par chimiothérapie orale à domicile, est censé faire l'objet d'une convention avec l'Assurance maladie et d'une rémunération (7).
La manipulation des antitumoraux oraux est moins délicate que celle des formes injectables, soumise à des précautions élevées en milieu hospitalier (b). La toxicité de ces médicaments, leur utilisation croissante à domicile, les insuffisances et la complexité de leurs conditionnements, sont à prendre en compte lors d'une utilisation notamment par des personnes peu familiarisées avec leur maniement (8).
Des conditionnements divers et à risque
La base de données sur les médicaments Thériaque (www.theriaque.org) répertorie environ 70 spécialités d'anticancéreux en flacons-vrac sur le marché français. Ces conditionnements font courir plus de risques de contamination, voire de perte d'un comprimé à l'insu du patient. Les présentations en plaquettes, de préférence unitaires, sont de meilleurs choix. Examinés en 2018 : Novatrex° (méthotrexate) en plaquettes est préférable à Méthotrexate Bellon° en flacon-vrac sans bouchon-sécurité. En 2018, nous n'avons pas observé de plaquette d'antitumoral recouverte d'un film anti-effraction, ni de boîte d'antitumoral munie d'un cran de sécurité pour éviter l'ingestion accidentelle par un enfant.
De plus, des posologies progressives telles que celle du vénétoclax° (Venclyxto°) ou régressives selon les effets indésirables telles que celle du ribociclib (Kisqali°), génèrent des plans de prises complexes qui nécessitent d'en vérifier la compréhension par les patients. Cette complexité se reporte parfois sur les présentations mises à disposition (nombreux dosages, conditionnements particuliers).
En pratique Pallier les défauts des conditionnements
Les soignants qui interviennent aux diverses étapes de prescription, dispensation, préparation des doses, administration et surveillance du traitement, sont bien placés pour observer les dangers potentiels et les erreurs liés aux conditionnements et à leur manipulation, et pour les déclarer aux autorités de pharmacovigilance. C'est pour que les professionnels de santé puissent anticiper ces risques et mieux protéger les patients que le Comité européen de pharmacovigilance (PRAC) a recommandé la mise à disposition des maquettes de conditionnements au sein des annexes des dossiers de demande d'AMM (1). Début 2019, ni l'ANSM ni l'Agence européenne du médicament (EMA) ne s'y sont conformées !
Synthèse élaborée collectivement par la Rédaction
sans aucun conflit d'intérêts
©Prescrire
Notes
a- Les recommandations de l'ANSM concernent les formes orales solides : comprimés, gélules, lyophilisats, capsules, poudres et granulés en sachets. Pour simplifier le propos, nous parlerons au fil du texte uniquement des comprimés et gélules qui représentent chaque année, toutes formes confondues, au moins la moitié des conditionnements examinés.
b- La dangerosité des cytotoxiques anciens pour les personnes les manipulant est relativement connue. Mais selon le Centers for Disease Control and Prevention (CDC) étatsunien, bien d'autres médicaments sont à considérer : abiratérone (Zytiga°), sunitinib (Sutent°), vémurafénib (Zelboraf°), etc. Ainsi que d'autres médicaments aux propriétés cancérogènes, mutagènes, ou fœtotoxiques voire tératogènes ; ou ceux exposant à une toxicité à faibles doses. Par exemple : alitrétinoïne (Toctino°) ; azathioprine (Imurel° ou autre) ; colchicine (Colchicine Opocalcium°) ; finastéride (Chibro-Proscar°, Propecia° ou autre) ; etc. (réf. 9).